L’essentiel en un clin d’œil
• Lupus systémique : résultats positifs dans une phase III pour le dapirolizumab, un anti-CD40L.
• Efficacité et tolérance du vaccin recombinant du zona dans le lupus systémique.
• Le blocage du FcRn par le nipocalumab, une nouvelle perspective dans la maladie de Sjögren.
TOP 1 – Le dapirolizumab, un anti-CD40L avec une phase 3 positive dans le lupus systémique
Le dapirolizumab (DPZ) est un fragment d’immunoglobuline (Fab) qui cible et inhibe le CD40L, couplé à du polyéthylène glycol afin de prolonger sa demi-vie.
L’étude
Une étude de phase III, multicentrique, randomisée et en double aveugle, a été menée, dans laquelle les patients ont été répartis dans un rapport de 2/1 pour recevoir soit 24 mg/kg de DPZ par voie intraveineuse toutes les 4 semaines ou un placebo en plus du traitement standard. Un objectif de décroissance de prednisone ≤ 7,5 mg/j était demandé dans les 8 semaines après l’inclusion.
Les critères d’inclusion étaient la présence d’une activité modérée dans au moins deux organes ou importante dans au moins un organe. Le critère principal de jugement était la réponse BICLA à 48 semaines.
L’étude a inclus 315 patients, dont 208 dans le groupe DPZ. Il s’agissait de 93 % de femmes, d’âge moyen de 43,5 ± 12,3 ans, dont 69 % présentaient un SLEDAI > 10, indiquant une forte activité clinique.
Les résultats
Il existait une différence significative entre les deux groupes de traitement, avec 49,6 % des patients traités par DPZ présentant une réponse contre 34,6 % dans le groupe placebo (p = 0,011) (Fig. 1). À la semaine 48, le critère LLDAS (faible activité avec une dose de corticoïdes ≤ 7,5 mg/j) était atteint par 40,9 % des patients sous DPZ contre 16,6 % dans le groupe placebo (p < 0,0001). Les critères secondaires (tels que le SRI-4 et le sevrage en corticoïdes) étaient également en faveur du groupe DPZ.
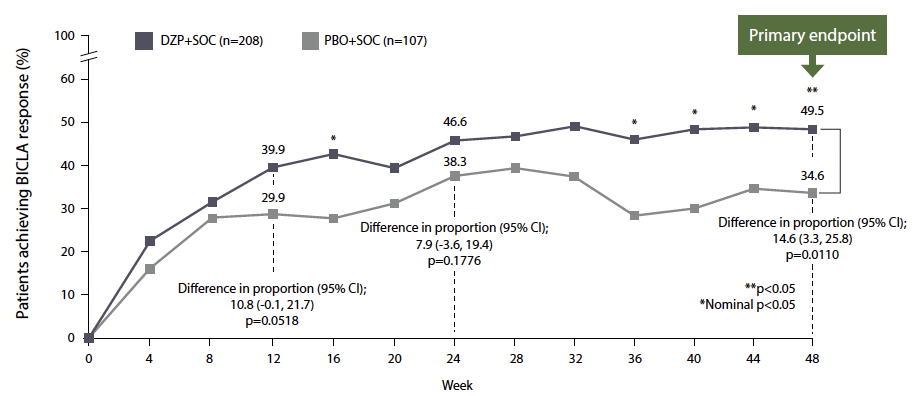
Figure 1 – Taux de réponse BICLA.
La tolérance était bonne, sans augmentation significative des effets indésirables ou des événements indésirables graves. Il était retrouvé une augmentation du taux d’infections bénignes, sans augmentation des infections modérées ou sévères. Les zonas étaient moins fréquents dans le groupe DPZ, probablement en raison de l’effet d’épargne des corticoïdes. Un cas d’infarctus du myocarde et un décès ont été rapportés dans le groupe DPZ.
• Clowse M, Isenberg D, Merrill J et al. Dapirolizumab pegol demonstrated significant improvement in systemic lupus erythematosus disease activity: efficacy and safety results of a phase 3 trial. ACR 2024 ; L16.
TOP 2 – Efficacité et tolérance du vaccin recombinant du zona dans le lupus systémique
Le calendrier vaccinal de 2024 recommande la réalisation du vaccin recombinant contre le zona dans la population générale de 65 ans et plus, et dès 18 ans en cas d’immunodépression. Ses modalités de délivrance restent complexes avec la nécessité de se rendre dans une pharmacie hospitalière avec la mention “dans le cadre de l’accès direct” apparaissant sur l’ordonnance.
Les patients atteints de lupus systémique présentent un risque accru de zona par rapport à la population générale, notamment lorsqu’ils sont traités par corticoïdes, et bloqueurs des interférons de type I (anifrolumab).
L’étude
L’objectif de cette étude était d’évaluer l’efficacité et la tolérance de ce vaccin chez les patients atteints de lupus systémique. Les auteurs ont analysé deux bases de données d’assurances : FDA Sentinel et Medicare. Les patients atteints de lupus systémique (identifiés par le code ICD-10) étaient inclus entre 2018 et 2023.
Pour chaque patient vacciné, quatre patients lupiques non vaccinés appariés sur l’âge et le sexe étaient identifiés. La tolérance au vaccin était évaluée par la survenue d’une poussée sévère dans les 90 jours suivant une injection de vaccin, et définie par l’introduction d’une corticothérapie ≥ 40 mg/j, la prescription de cyclophosphamide ou une hospitalisation liée au lupus. L’efficacité était mesurée à partir de la deuxième dose, en analysant la survenue d’un zona nécessitant un traitement antiviral.
Les résultats
L’analyse a porté sur 3 592 patients vaccinés et 14 024 patients non vaccinés, d’âge moyen 62,9 (± 8,9) ans et dont 90,5 % étaient des femmes. Un tiers des patients étaient sous traitement par corticoïdes, et 72 % étaient traités par des immunosuppresseurs, tandis que l’utilisation des anticorps anti-CD20 était rare (1,6 %).
L’efficacité du vaccin oscillait entre 54 et 70 %, ce qui est un excellent résultat pour une population immunodéprimée (Fig. 2).
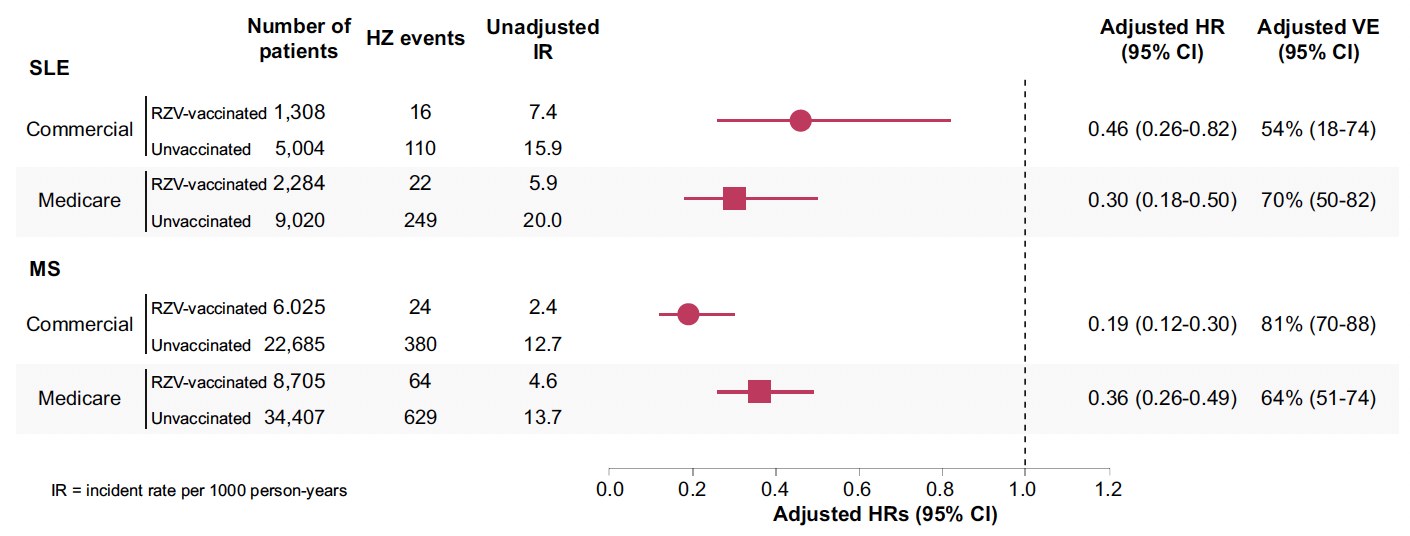
Figure 2 – Efficacité du vaccin recombinant du zona.
En ce qui concerne la tolérance, il n’a pas été observé d’augmentation du risque de poussée sévère (HR = 0,91 ; IC 95 % = 0,72-1,24).
À retenir
Au total, cette étude confirme l’efficacité du vaccin recombinant zona dans le lupus et nous permet de rassurer nos patients quant à sa tolérance.
• Kluberg S, Mayer SE, Spence OM et al. Effectiveness and safety of the recombinant zoster vaccine in patients ≥18 years of age with systemic lupus erythematosus or multiple sclerosis. ACR 2024 ; 0844.
TOP 3 – Le blocage du FcRn par nipocalumab, une nouvelle perspective dans la maladie de Sjögren
Dans la maladie de Sjögren, et en particulier dans ses formes systémiques, on note une activation des LB, ce qui se traduit par une hypergammaglobulinémie avec la présence d’auto-anticorps de type anti-SSA/SSB. La voie du Fc récepteur néonatal (FcRn) est responsable du recyclage des immunoglobulines G (IgG) circulantes par les cellules endothéliales, ce qui prolonge leur demi-vie. Bloquer ce processus de recyclage des immunoglobulines pourrait permettre de réduire le titre des auto-anticorps.
L’étude DAHLIAS
L’essai DAHLIAS était une étude de phase II, randomisée, contrôlée contre placebo, dans laquelle des patients atteints de la maladie de Sjögren immunopositifs pour le SSA+ et ayant une activité systémique (ESSDAI ≥ 6) étaient inclus. Les patients étaient randomisés pour recevoir du nipocalimab à des doses de 5 ou 15 mg IV toutes les 2 semaines, ou un placebo. Le critère de jugement principal était l’évolution du score ESSDAI à la semaine 24.
Cent soixante-trois patients étaient inclus dont 92,6 % de femmes d’âge moyen de 48 ans (étendue : 20-73 ans). Le score ESSDAI moyen était de 10, indiquant une activité systémique importante, et les patients présentaient également un fardeau symptomatique significatif, avec un score ESSPRI de 7,1/10.
Les résultats
À 24 semaines, une réduction significative du score ESSDAI clinique a été observée dans le groupe traité par nipocalimab à la dose de 15 mg/kg (et non 5 mg/kg) par rapport au placebo (p = 0,002) (Fig. 3). La baisse des IgG totales circulantes était dose-dépendante.
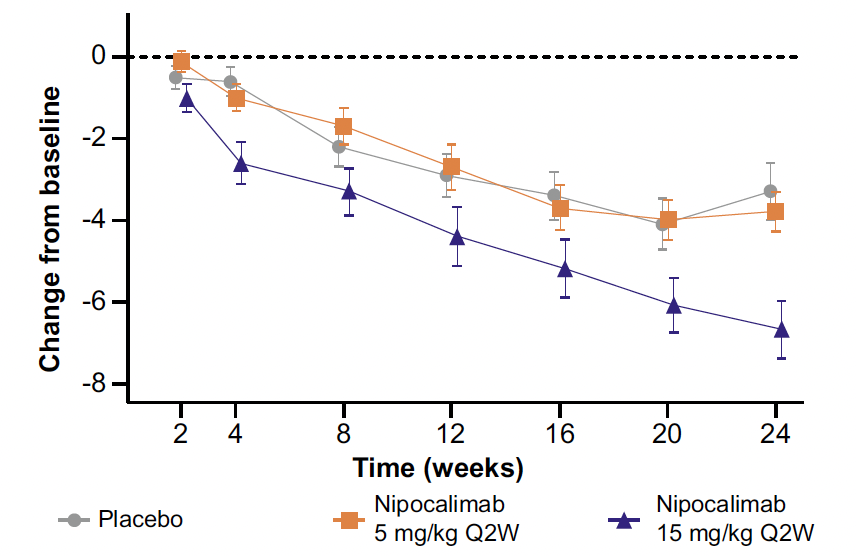
Figure 3 – DAHLIAS : évolution du score ESSDAI clinique durant le suivi.
Plusieurs critères secondaires ont montré des différences significatives en faveur du nipocalumab :
• réduction de l’évaluation de la maladie par le médecin (PhGA),
• amélioration du critère composite de réponse STAR
• et augmentation du flux salivaire non stimulé.
Cependant, l’effet sur le score ESSPRI n’était pas significatif. L’analyse de la réponse clinique en fonction du taux d’auto-anticorps (ENA) a révélé un effet plus marqué du nipocalimab chez les patients ayant les plus hauts taux d’auto-anticorps
(≥ 3e tertile).
En ce qui concerne la tolérance, le risque d’infection était similaire entre les groupes, sans infection opportuniste observée. Il n’y avait pas d’autre signal de sécurité, notamment cardiovasculaire. Sur le plan biologique, les variations des paramètres biologiques (albumine, LDL…) n’étaient pas cliniquement significatives.
À retenir
Compte tenu de ces résultats prometteurs, un essai de phase III est en cours, et également un autre essai portant sur les pathologies materno-fœtales immuno-médiées (ie. incompatibilité rhésus).
• Gottenberg JE, Sivils K, Campbell K et al Efficacy and Safety of Nipocalimab, an Anti-FcRn Monoclonal Antibody, in Primary Sjogren’s Disease: Results from a Phase 2, Multicenter, Randomized, Placebo-Controlled, Double-Blind Study (DAHLIAS). ACR 2024 ; 2527.
L’auteur déclare ne pas avoir de liens d’intérêt en rapport avec cet article.




