TOP 1 – Essai APIPPRA : abatacept chez des patients à risque de développer une polyarthrite
Plusieurs essais de « prévention » de la polyarthrite rhumatoïde (PR) ont vu le jour ces dernières années (TREAT EARLIER avec le méthotrexate). Il s’agit d’essais thérapeutiques s’intéressant à une population de patients à risque de développer une PR, c’est-à-dire des sujets avec arthralgies sans synovite clinique et présentant les marqueurs d’auto-immunité.
L’essai APIPPRA est un essai randomisé de phase IIb évaluant l’abatacept (ABA) SC comparativement à un placebo chez des patients avec arthralgies ACPA+ et facteurs rhumatoïdes (FR)+ ou ACPAélevé et FR–. Il complète les données de l’essai ARIAA qui analysait les données de l’inflammation en imagerie IRM sous abatacept ou placebo chez des sujets pré-PR. Dans l’étude APIPPRA, les patients recevaient ABA 125 mg SC/sem ou un placebo pendant 52 semaines, avec un suivi supplémentaire d’1 an. Ils ne devaient pas avoir reçu de corticothérapie, un DMARD et avoir présenté de synovite. Le critère principal d’évaluation était le délai du développement de synovites cliniques (au moins trois articulations) ou d’une PR selon les critères ACR 2010. Les synovites étaient confirmées par une échographie. Au total, 213 patients étaient randomisés, 110 dans le bras ABA, 103 dans le bras placebo ; 93 % des patients étaient ACPA élevé. L’échographie à l’inclusion montrait des signes minimes d’inflammation synoviale (73 % des sujets avaient une activité Doppler nulle). À 1 an, le nombre d’événements pris en compte dans le critère d’évaluation principal était de 30 sous placebo versus sept sous ABA (29 vs 6 %). À la fin du suivi, le nombre d’événements était de 37 vs 25 %, ce qui correspond à une période sans arthrite de 99,2 jours en faveur du groupe ABA (IC 95 % : 37,5- 160,9 ; p = 0,002) (Fig. 1). Les patients à haut titre en ACPA avaient la probabilité la plus élevée de rester sans arthrite. L’analyse des critères secondaires montrait des scores HAQ et douleur bas et EQ-5L haut sous ABA comparativement au placebo.
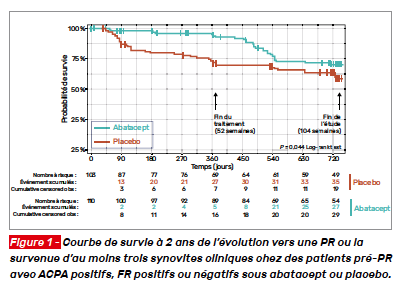
Cette nouvelle étude interventionnelle sur une population de pré-PR montre un effet favorable de l’ABA sur la réduction du risque évolutif vers une PR à 2 ans. Ces données vont dans le sens d’un effet de ralentissement des bDMARDs sur le potentiel évolutif des pré-PR, lorsqu’ils sont administrés précocement.
• Krijbolder DI, Verstappen M, van Dijk B et al. Intervention with methotrexate in patients with arthralgia at risk of rheumatoid arthritis to reduce the development of persistent arthritis and its disease burden (TREAT EARLIER): a randomised, double-blind, placebo-controlled, proof-of-concept trial. Lancet 2022 ; 400 : 283-94.
• Gerlag DM, Safy M, Maijer KI et al. Effects of B-cell directed therapy on the preclinical stage of rheumatoid arthritis: the PRAIRI study. Ann Rheum Dis 2019 ; 78 : 179-85.
• Rech J et al. Abatacept Significantly Reduces Subclinical Inflammation During Treatment (6 Months), This Persists After Discontinuation (12 Months), Resulting in a Delay in the Clinical Development of RA in Patients at Risk of RA (The ARIAA Study). ACR 2022 ; abstr. 0530.
• Cope A et al. Abatacept in Individuals at Risk of Developing Rheumatoid Arthritis: Results from the Arthritis Prevention in the Pre-clinical Phase of RA with Abatacept (APIPPRA) Trial. ACR 2023 ; abstr. 0835
TOP 2 – Stimulation du nerf vague dans la polyarthrite : un essai randomisé
Nous avions vu les résultats d’un essai ouvert (portant sur 30 patients) avec cette technique de stimulation du nerf vague dans la PR, avec des résultats encourageants (réduction des scores d’activité DAS28-CRP et réponse ACR).
Il s’agit ici d’un essai randomisé utilisant cette technique avec un bras contrôle « sham ». Les patients avaient une PR ne répondant pas suffisamment aux csDMARDs et étaient naïfs de bDMARDs ou tsDMARDS. Ils recevaient une stimulation auriculaire du nerf vague (unilatérale N = 52 ou bilatérale N = 9) ou une procédure simulée « sham » (N = 52). Le critère principal d’évaluation était la réponse ACR20 à la semaine 12. Au total, 113 patients étaient inclus et 101 ont complété l’étude. Le taux d’ACR20 à la semaine 12 ne différait pas significativement entre les deux groupes : 25 % dans le groupe stimulation active versus 26,9 % dans le groupe « sham » (p = 0,82) (Fig. 2). Il n’y avait également pas de différence pour la plupart des critères secondaires (DAS28-CRP < 2,6, ACR50 ou ACR70, CDAI, SDAI), hormis la variation du HAQ (stimulation active versus « sham » : -0,19 vs -0,02 (p = 0,04).
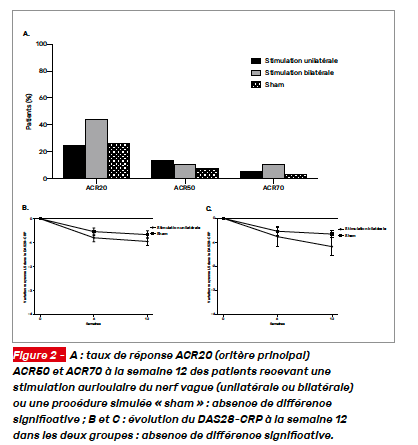
Cette procédure était globalement bien tolérée. Ces résultats ne montrent donc pas d’efficacité clinique de la stimulation auriculaire du nerf vague dans la PR.
• Genovese MC et al. First-in-human study of novel implanted vagus nerve stimulation device to treat rheumatoid arthritis. Eular 2019 : abstr. LB009.
• Baker M et al. A Randomized, Double-Blind, Sham-Controlled, Clinical Trial of Auricular Vagus Nerve Stimulation for the Treatment of Active Rheumatoid Arthritis. ACR 2023 ; abstr. 0837.
TOP 3 – Données d’efficacité du nipocalimab, anticorps anti-récepteur Fc dans la polyarthrite : un essai de phase IIa
Le nipocalimab (NIP) est un anticorps de haute affinité ciblant le récepteur Fc des immunoglobulines, permettant de contrôler l’action/circulation des auto-anticorps sur leur récepteur, dont les ACPA. L’essai IRIS-RA (clinicalTrial.gov NCT04991753) est un essai preuve de concept de phase IIa évaluant NIP chez des patients PR. Il s’agissait de patients PR ACPA+ ou FR+ ayant reçu au moins un traitement ciblé. Les patients étaient randomisés pour recevoir NIP par voie IV 15 mg/kg ou un placebo toutes les 2 semaines pendant 10 semaines. Le critère principal de jugement était la variation du DAS28 CRP entre l’inclusion et la semaine 12. 53 patients participaient à cet essai (NIP N = 33, placebo N = 20). La variation du DAS28-CRP à la semaine 12 ne différait pas entre les groupes NIP et placebo : -1,17 et -0,62, respectivement (p = 0,224) (Fig. 3). Les taux de réponse ACR20/50/70 étaient numériquement plus élevés sous NIP comparativement au placebo. Le traitement était bien toléré.
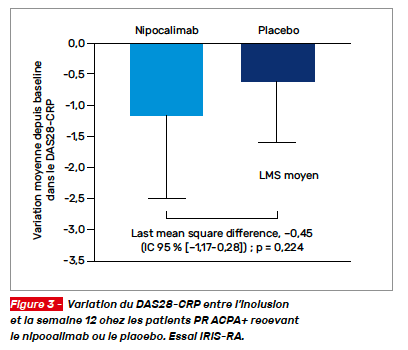
Ces données préliminaires sont négatives et nécessitent donc des évaluations supplémentaires afin de déterminer si cet agent ciblé présente un intérêt dans le traitement de la PR ACPA+.
Taylor P et al. Efficacy and Safety of Nipocalimab in Patients with Moderate to Severe Active Rheumatoid Arthritis (RA): The Multicenter, Randomized, Double-blinded, Placebo-controlled Phase 2a IRIS-RA Study. ACR 2023 ; abstr. 0839.
TOP 4 – Une étude face à face comparant un anti-JAK1/TYK2 au tofacitinib dans la polyarthrite : essai de phase IIa
Le TLL-018 est un inhibiteur de JAK1/TYK2. Il s’agit d’un nouvel anti-JAK qui a été évalué dans un essai de phase précoce dans la PR. Cet agent synthétique est développé en Chine.
Le schéma de l’étude était celui d’une comparaison de cet anti- JAK1/TYK2 au tofacitinib (TOFA), anti-JAK1/2/3. Remarquons que nous ne disposons d’aucune étude comparant les anti-JAK entre eux. Les patients ne répondant pas ou intolérant au méthotrexate étaient randomisés pour recevoir deux fois par jour TLL-018 10, 20, 30 ou le TOFA 5 mg. À la semaine 12, les patients répondeurs ACR50 continuaient leur traitement et ceux ne répondant pas suivaient le changement suivant : les groupes TOFA et TLL-018 10 mg recevaient TLL-018 20 mg ; ceux des groupes TLL-018 20 et 30 mg recevaient TLL-018 30 mg. Le critère principal de jugement était le taux de réponse ACR50 à la semaine 12. Au total, 101 patients étaient inclus (comportant 50 % de prise antérieure de bDMARDs et 30 % de JAKi). Les taux de réponse ACR50 à la semaine 12 étaient plus élevés dans les groupes TLL-018 que dans le groupe TOFA, avec une différence significative pour les groupes 20 et 30 mg comparativement au TOFA (Tab. 1). Sur le plan tolérance, deux cas d’herpès étaient observés dans le groupe TLL-018 20 mg. Il n’y avait pas de complications thrombo-emboliques ou d’événements cardiovasculaires majeurs dans cet essai de phase précoce qui montre une supériorité du TLL-018 pour les doses de 20 et 30 mg sur le TOFA.
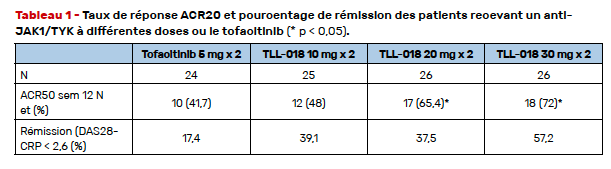
Ces données nécessitent d’être confirmées dans un essai de plus grande ampleur avec des données d’une étude internationale et il manque par ailleurs une comparaison avec un groupe placebo. Remarquons également des taux de réponse ACR50 importants pour les doses élevées de TLL-018.
Zeng X et al. Head-to-Head Comparison of TLL-018 and Tofacitinib in Patients with Active Rheumatoid Arthritis: Final Results from a Phase IIa Study. ACR 2023 ; abstr. 0840.
TOP 5 – Le télitacicept dans la polyarthrite : un essai de phase III
Le télitacicept (TELI) est une protéine de fusion ciblant les cytokines BLyS (BAFF) et APRIL. Il s’agit d’une fusion du récepteur TACI des cytokines d‘activation du lymphocyte B et du fragment Fc d’une IgG (Fig. 4). Il a été testé dans le lupus avec des résultats intéressants et est autorisé en Chine dans cette indication. Il cible donc les lymphocytes B auto-réactifs. Toutefois, les précédentes interventions ciblant BAFF n’avaient pas donné de résultats probants dans la polyarthrite.
Il s’agit ici d’un essai de phase III chez des PR ne répondant pas au méthotrexate (MTX) (ClinicalTrial.gov : NCT03016013). Les patients étaient randomisés pour recevoir TELI 160 mg ou le placebo chaque semaine pendant 24 semaines. Cette période était suivie d’une phase d’extension en ouvert jusqu’à la semaine 48, les patients du groupe placebo étant switchés pour recevoir TELI. Le critère principal d’évaluation était le taux de réponse ACR20 à la semaine 24. Au total, 479 patients étaient randomisés dans les deux bras (TELI N = 360, placebo N = 119). La réponse ACR20 était meilleure dans le groupe TELI comparativement au placebo : 60 versus 26,9 % (p < 0,001) (Fig. 5). Les critères secondaires (ACR50 semaine 24, réduction du DAS28-CRP entre inclusion et semaine 24, variation du score HAQ) étaient de même significativement améliorés sous TELI versus placebo. La progression radiographique à 24 semaines était de même moindre sous TELI comparativement au placebo (absence de progression à la semaine 24 : 90,2 % sous TELI vs 66,4 % sous placebo ; p < 0,001). Le traitement était bien toléré avec des taux d’infections équivalents entre les deux bras (TELI vs placebo : 41 vs 42 % ; huit infections sévères sous TELI vs quatre sous placebo).
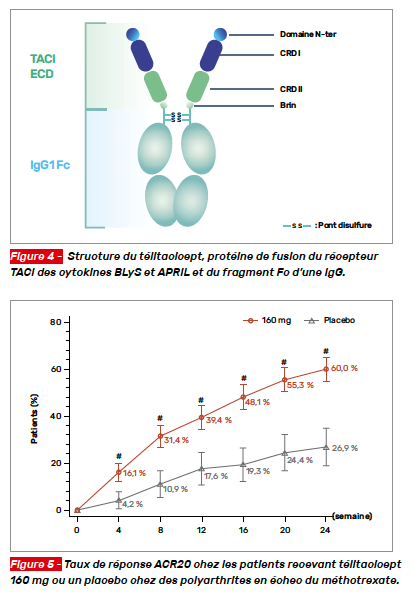
Les résultats de cet essai de phase III sont donc intéressants et prometteurs pour un développement de cette protéine de fusion. Il nécessitera également d’être évalué sur d’autres populations de PR en dehors de la Chine.
• Wu D et al. Telitacicept, a Human Recombinant Fusion Protein Targeting B Lymphocyte Stimulator (BlyS) and a Proliferation-Inducing Ligand (APRIL), in Systemic Lupus Erythematosus (SLE): Results of a Phase 3 Study. ACR 2022 ; abstr. L07.
• Wang L et al. Telitacicept, a Human Recombinant Fusion Protein Targeting and Neutralizing B Lymphocyte Stimulator (BlyS) and a Proliferation-Inducing Ligand (APRIL), in Rheumatoid Arthritis (RA) Patients with an Inadequate Response to Methotrexate (MTX): A Randomized, Double-Blind, Phase 3 Study. ACR 2023 ; abstr. L20.
L’auteur déclare ne pas avoir de lien d’intérêt pour cet article.




