Depuis les années 1990, l’acide hyaluronique (AH) injectable fait partie de l’arsenal thérapeutique en pathologie musculosquelettique, qu’il s’agisse d’injections intra-articulaires dans l’arthrose, dans les gaines tendineuses ou en péritendineux dans certaines tendinopathies et rétinaculopathies. C’est un traitement bien toléré (1, 2) quoiqu’en dise une méta-analyse récente (3) qui n’a pas discuté l’imputabilité des événements indésirables rapportés dans quelques articles. Ses propriétés sont multiples, lubrifiantes, antalgiques, anti-inflammatoires, visco-inductrices et probablement chondroprotectrices, ce qui permet de l’intégrer dans les traitements de cette nouvelle entité qu’est la médecine régénérative.
Introduction
Contrairement à sa dénomination de viscosupplément, l’AH ne supplémente pas le liquide synovial, les effets cliniques étant retardés de plusieurs semaines, survenant bien après la disparition du produit injecté. Il ne devrait pas être classé comme dispositif médical. Il n’est plus remboursé en France depuis 2017 et, malgré cela, les ventes seraient revenues au niveau d’avant le déremboursement, avec davantage de mono-injections.
Indications
Les injections intra-articulaires d’AH font partie des recommandations de la SFR dans le traitement de la gonarthrose (4). Il est largement préconisé et utilisé dans la pathologie arthrosique des grosses et petites articulations. Son usage en pathologie tendineuse et ténosynoviale est plus limité (5-7). Le groupe d’experts EUROVISCO a produit de nombreuses publications détaillant les différentes indications et proposant des algorithmes dans nombre de situations cliniques (8-12).
Des réponses variables
Si l’efficacité à long terme de ce traitement reste encore contestée par certains, c’est principalement en raison de la variabilité des réponses des patients potentiellement attribuable à des différences dans les caractéristiques des patients, la gravité de la maladie, les techniques d’injection et la formulation du produit (13). On a beaucoup critiqué le manque de standardisation des PRP, mais il existe aussi avec les AH injectables, dans de moindres proportions.
De nombreuses formulations
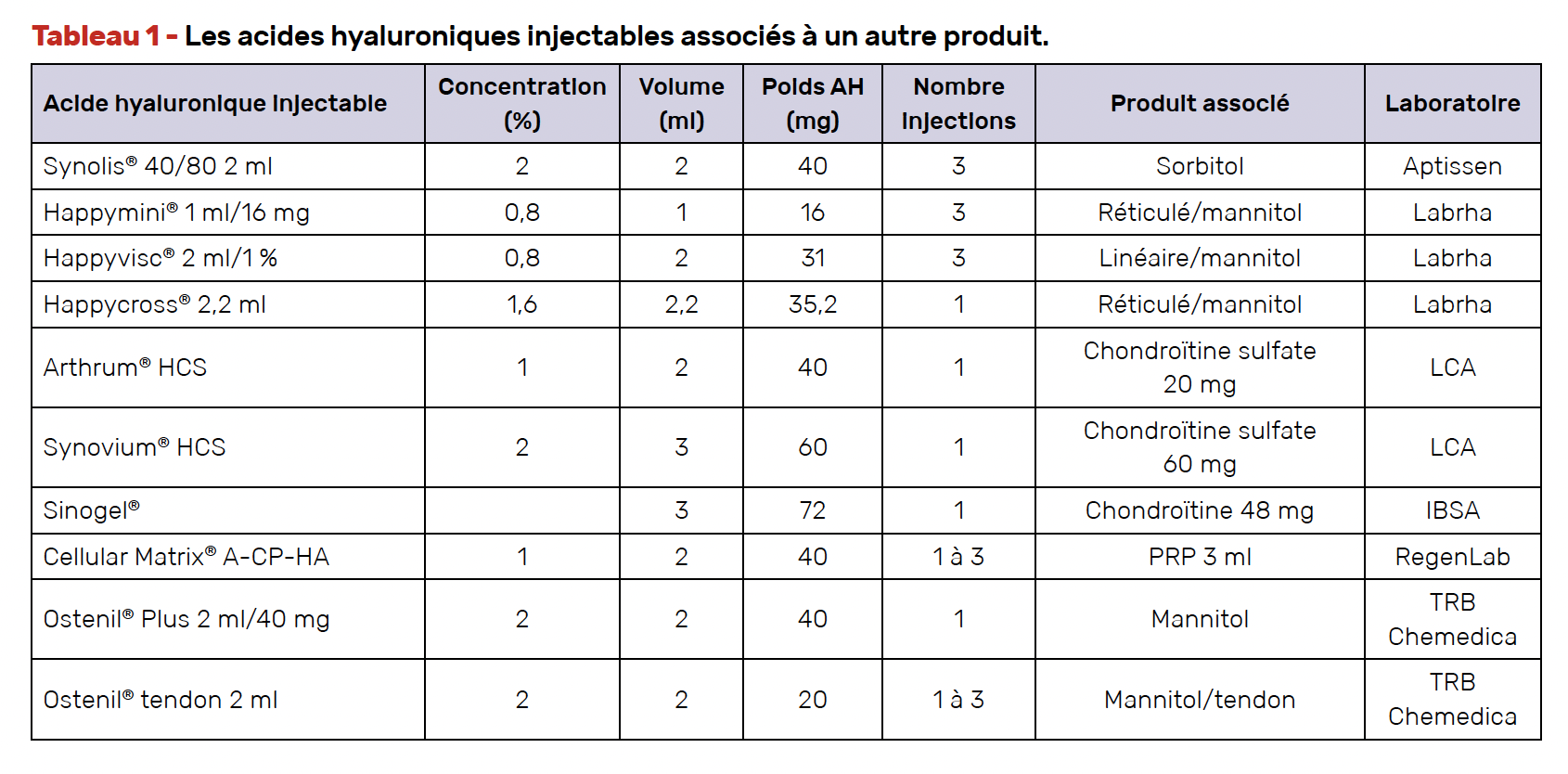
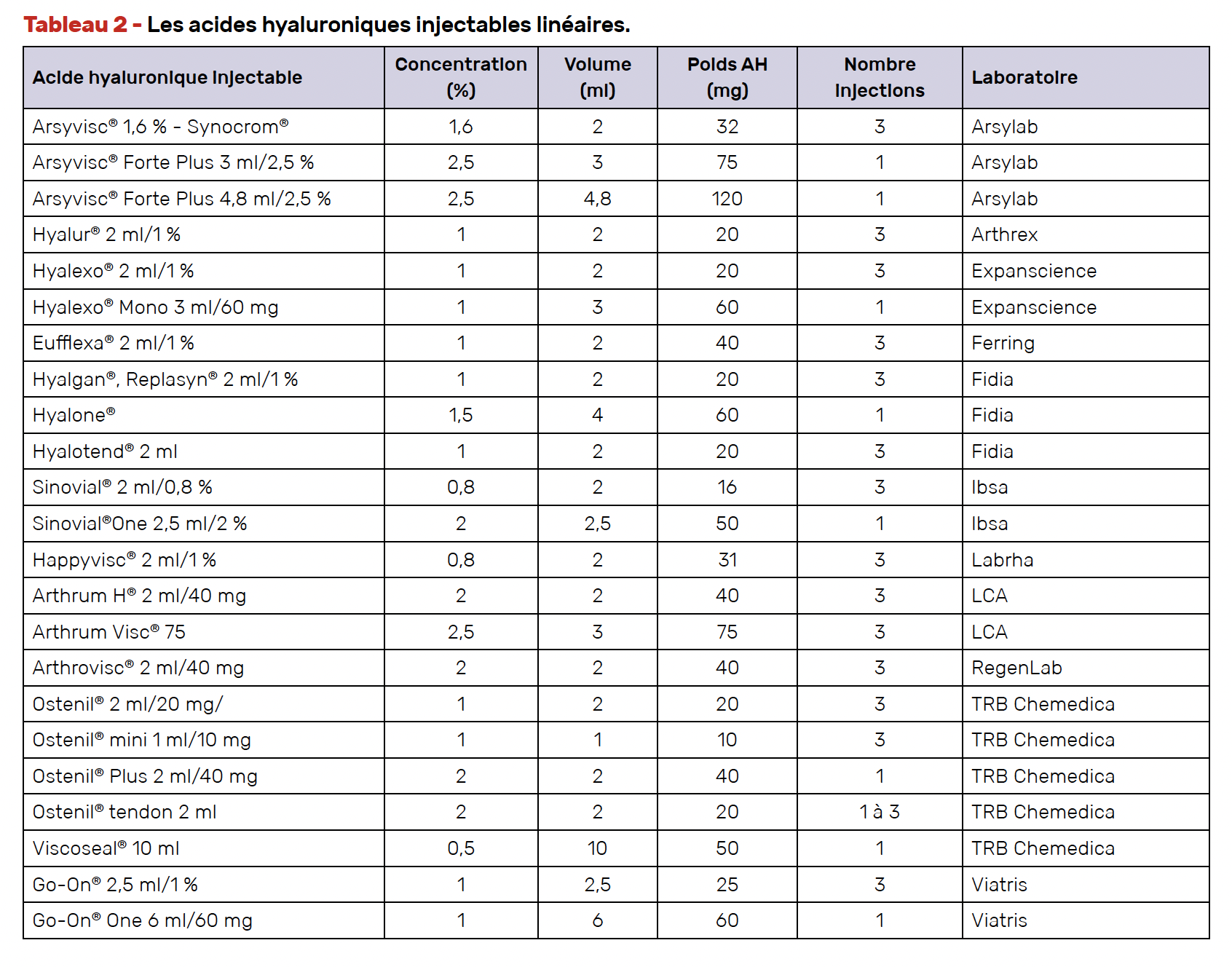
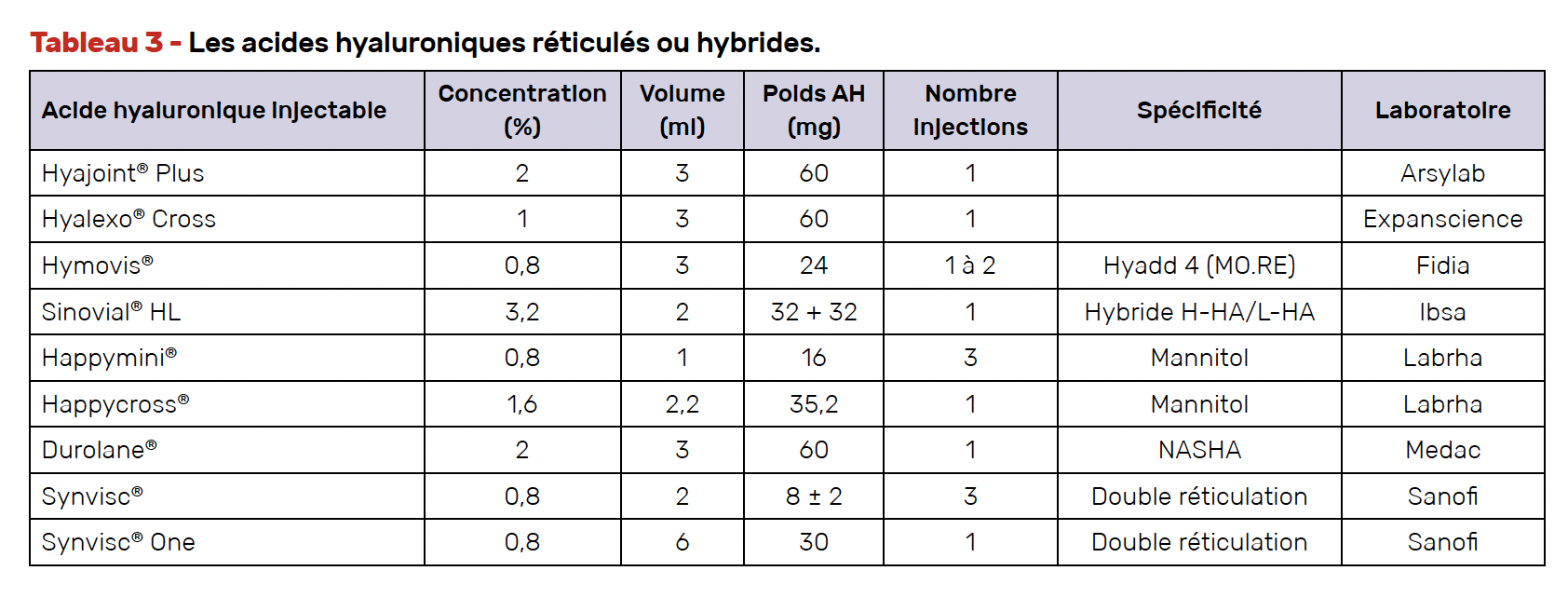
Nous disposons en effet de nombreuses formulations d’AH injectable avec des poids moléculaires (PM), des concentrations, des volumes et des sources différentes (animale ou par fermentation bactérienne), certains étant réticulés, d’autres dits linéaires, quelques-uns contenant un polyol, mannitol ou sorbitol, voire d’autres produits. Les figures 1 et 2 illustrent la chronologie de l’évolution des formulations et les six axes de développement. Des débats ont eu lieu concernant l’influence du PM, de la concentration, de la réticulation, de la présence d’un polyol, mais la plupart des quelques études comparatives ont peiné à montrer la supériorité de l’un par rapport à l’autre, avec l’inconvénient d’un suivi limité le plus souvent à 6 mois. Nous avons répertorié 40 formulations commercialisées en France et l’encadré 1 montre les différentes répartitions.

Figure 1 – Évolution des acides hyaluroniques injectables en 32 ans (d’après Migliore A, communication à l’ISIAT 2023).

Figure 2 – Différents axes de développement de l’acide hyaluronique injectable.

Nous allons voir l’influence de ces différences qui visent à renforcer le temps de résidence, à associer un autre effet biologique ou à faciliter l’injection.
Rôle de la quantité, de la concentration et du poids moléculaire de l’acide hyaluronique
Si les injections intra-articulaires d’AH (IAH) dans la gonarthrose sont recommandées, sous certaines conditions, par une majorité de sociétés scientifiques (4, 14-16), il n’existe curieusement aucun consensus sur la quantité d’AH idéale, ni sur la concentration optimale. Les doses moyennes totales en triple injection sont de l’ordre de 60 mg (3 x 20 mg). Avec les monodoses, le poids d’AH peut varier selon un rapport de 1 à 5, allant de 32 mg avec une nouvelle formulation (Hymovis®) à 120 mg (Arsyvisc® Forte Plus).
On peut donc s’interroger sur la pertinence de telles différences de dosage, sachant que la molécule d’AH reste la même d’une formulation à l’autre, ne variant que par son PM et sa configuration tridimensionnelle, réticulée ou linéaire (17).
Intérêt d’une haute densité
Une haute densité de 120 mg d’AH a fait l’objet d’une étude observationnelle, prospective et multicentrique espagnole sous le nom de Pronolis® HD 120 4,8 ml/2,5 %, sur 166 genoux arthrosiques (âge moyen 63,2 ans, sex ratio F 75,9/H 24,1, grades radiographiques : II 23,5 % ; III 68,1 % ; IV 8,4 %, IMC moyen 28,6) qui montre une efficacité > 50 % sur l’EVA chez 37,9 % des patients à 3 semaines montant à 66 % à 24 semaines, avec une tolérance correcte, trois patients (1,6 %) ayant eu un gonflement modéré transitoire (18). Il manque une étude comparative avec un produit contenant moins d’AH.
Un mécanisme de régulation de la concentration physiologique
Plusieurs méta-analyses soulignent l’intérêt d’un PM plus élevé (19-21), mais aucune ne mentionne de différences d’efficacité liées à la dose totale injectée. Rappelons qu’un genou sain ne contient en moyenne que 4 à 10 mg d’AH (22) et que des modèles expérimentaux chez l’animal ont permis d’identifier un mécanisme de régulation qui implique une augmentation de la clairance articulaire de l’AH en fonction de la dose injectée (22). Plus simplement, plus la quantité d’AH injectée est importante, plus son élimination est accélérée afin de rétablir un niveau de concentration physiologique d’AH lorsqu’il est artificiellement augmenté.
Effet du temps de séjour dans les tissus articulaires
Pour Balazs et Denliger (22), initiateurs du concept de viscosupplémentation, l’efficacité d’un viscosupplément dépend de ses propriétés rhéologiques et de son temps de séjour dans les tissus articulaires. Ce dernier est bref (2-3 jours) pour l’AH à structure linéaire (23) et jusqu’à 10 fois plus long pour l’AH réticulé (24, 25). Aucun travail n’a encore démontré que l’augmentation du volume injecté ou de la concentration de l’AH pouvait prolonger le temps de résidence intra-articulaire de l’AH, ni améliorer l’efficacité symptomatique. Une seule étude in vitro chez l’animal a montré un effet chondroprotecteur supérieur d’une dose plus élevée d’AH (Sinovial®) par rapport au même AH à une concentration deux fois plus élevée (26). Cependant, il est difficile d’extrapoler ces résultats à la clinique, car cette étude ne tient pas compte de la vitesse d’élimination du viscosupplément.
Effet de la dose injectée
Pour étayer l’hypothèse selon laquelle la quantité d’AH n’influence pas significativement le résultat clinique, l’un de nous (TC) a effectué une analyse post-hoc de deux études prospectives, réalisées dans des conditions strictement similaires chez des patients traités par mono-injection d’AH pour une gonarthrose symptomatique, comparant un AH réticulé avec mannitol (HANOX-M-XL) à un AH non réticulé, sans mannitol, de PM entre 2,3 et 3,6 Da 20 mg/ml. Dans l’étude 1 (27), les patients ont reçu une dose unique de 2,2 ml de HANOX-M-XL (Happycross®), un viscosupplément composé de 16 mg/ml d’AH réticulé, couplé à 35 mg/ml de mannitol. Dans l’étude 2 (28), des patients comparables ont reçu deux doses (4,4 ml) du même viscosupplément au cours de la même séance. Ainsi, les premiers ont reçu 35,2 mg d’AH et les seconds 70,4 mg. Les populations au jour de l’injection (J0) et les résultats cliniques à 6 mois (M6) ont été comparés. Les critères d’efficacité étaient le changement de l’indice WOMAC (A douleur, C fonction), l’évaluation globale de la douleur par le patient (PGA) et l’évaluation de l’efficacité du traitement par le patient (faible, moyen, bon, très bon). Les événements indésirables attribuables au traitement ont été comparés. Au total, 93 patients (53 dans l’étude 1 et 40 dans l’étude 2) ont été analysés. À J0, les populations des deux études étaient strictement comparables en termes de démographie et de caractéristiques cliniques.
À M6, une amélioration significative de la douleur (p < 0,0001), de la fonction (p < 0,0001) et de la PGE (p < 0,001) a été observée dans les deux études, sans différence entre elles. L’efficacité a été jugée très bonne ou bonne dans 77,3 et 76,9 % des cas, respectivement. Des effets indésirables locaux ont été signalés chez 5,7 et 5 % des patients.
Malgré les limites de cette étude, cette analyse suggère fortement que l’augmentation de la quantité d’AH injectée n’apporte aucun bénéfice clinique en termes de douleur ou de fonction, mais n’augmente pas non plus le risque d’effets indésirables. Il semble donc inutile d’augmenter les doses, le volume ou la concentration en cas d’échec d’un précédent traitement de viscosupplémentation. Des études complémentaires sont nécessaires pour déterminer la dose “optimale” d’AH à injecter, qui peut dépendre du PM et vraisemblablement du temps de résidence dans le dispositif, mais qui pourrait être bien inférieure à celles utilisées actuellement.
Rôle du volume injecté
Si l’articulation du genou peut accepter une quantité importante de produit, le volume injecté pour les corticostéroïdes ne dépasse généralement pas les 2 ml et le volume pour les AH varie de 2 à 6 ml. Il n’y a pas d’effet “viscosupplément” immédiat vraiment démontré avec les hauts volumes et la plupart des AH ont un volume de 2 à 3 ml. Il existe une formulation de 10 ml, Viscoheal® destiné aux chirurgiens orthopédiques pour un usage en fin d’arthroscopie. On a vu plus haut que la quantité de 30 à 60 mg d’AH était suffisante et la concentration qui varie de 0,8 à 2,5 % ne semble pas jouer un rôle tant dans l’efficacité que dans la tolérance.
Ajout d’un autre produit
Les polyols
Les polyols sont des glucides faiblement digestibles, très utilisés comme édulcorants et en pharmacie comme excipients, mais le mannitol et le sorbitol sont des substances actives ayant un effet thérapeutique. En association avec l’AH, ils protègent celui-ci d’une dépolymérisation trop rapide par une action antioxydante sur les radicaux libres qui est dose-dépendante pour le mannitol (29, 30). Celui-ci a un effet anti-inflammatoire propre (31) et agit aussi sur l’apoptose (32). Son association à l’AH a pour effet d’augmenter, in vitro, le temps de résidence de celui-ci dans l’articulation (33). L’effet antioxydant de ces polyols peut apporter un effet antalgique plus précoce, comme l’a démontré un essai contrôlé en double aveugle comparant un viscosupplément modifié par le mannitol à l’AH ordinaire (28). L’ajout de mannitol et de sorbitol à l’AH ne modifie pas la sécurité et la tolérance locale.
En résumé, l’ajout d’un polyol à l’AH peut améliorer les effets de la viscosupplémentation en réduisant le taux de dégradation de l’AH, ce qui entraîne un effet plus rapide sur le soulagement de la douleur sans augmenter le risque d’effets indésirables (27). D’autres études ont montré au moins la non-infériorité de cette association par rapport à un produit de référence (34).
La chondroïtine
La chondroïtine sulfate
L’Arthum HCS®, qui associe 40 mg d’AH linéaire à 40 mg de chondroïtine sulfate dans une seringue de 2 ml, est commercialisé depuis plusieurs années et a fait l’objet d’une étude ouverte prospective multicentrique en 2016 sur 120 patients (F 66 %) montrant sa bonne tolérance et une efficacité, le sous-score A moyen (SD) de WOMAC ayant diminué de 52,1 (15,2) à l’inclusion à 20,5 (19,7) au 6e mois (p < 0,0001) avec une amélioration ressentie significative dès le premier mois (35).
On attend une étude randomisée contrôlée pour juger de l’apport réel de la chondroïtine sulfate en intra-articulaire associée à l’AH.
La chondroïtine non sulfatée
Le laboratoire Ibsa commercialise depuis peu une association un peu équivalente dénommée Sinogel® comprenant un AH hybride d’environ 1 000 kDa concentré à 2,4 % et de la chondroïtine non sulfatée (1,6 %) d’origine biotechnologique pour laquelle on ne dispose que d’une étude pilote, ouverte, prospective et multicentrique cette fois dans la coxarthrose en une seule injection (36). Cette étude a porté sur 48 cas ayant une coxarthrose de stade II ou III et a montré, outre une bonne tolérance, une réduction de l’indice de Lequesne moyen de 10,4 à 5,1 à 6 mois et de l’EVA de -44,7 ± 23,7. Ce produit est disponible en France depuis le mois d’avril.
La niacinamide
Outre la dégradation enzymatique spécifique par les hyaluronidases, les molécules d’AH sont exposées aux attaques des radicaux hydroxyles, ce qui entraîne la scission des liaisons glycosidiques. On a vu l’intérêt des polyols pour lutter contre cela. La niacinamide (ou nicotinamide) est la vitamine B3 ou PP, hydrosoluble, dérivé de l’acide nicotinique (ou niacine). Cette vitamine a déjà fait parler d’elle dans le traitement de l’arthrose (37, 38). C’est un puissant antioxydant. Son association à un AH améliore la stabilité et potentialise les principaux effets de l’AH dans les articulations arthrosiques. La spécialité Innoryos® est un AH linéaire de PM intermédiaire de 1,2 à 2,2 kDa concentré à 2,2 %, soit 22 mg/ml, associé à de la niacinamide à 1,5 % dans une seringue de 2 ml, avec une injection hebdomadaire pendant 3 semaines. Cette spécialité n’est plus commercialisée en France.
Résultats
Il a été comparé expérimentalement in vitro et ex vivo avec trois autres viscosuppléments à base de hyaluronane disponibles dans le commerce (Ostenil® 2 ml/1 %, Ostenil® Plus 2 ml/2 %, Synvisc® 2 ml/0,8 %), dans le but de procéder à une évaluation fonctionnelle, en se concentrant sur les caractéristiques critiques suivantes : rhéologie, lubrification, adhésion et stabilité (39). On a donc quatre types d’AH, un linéaire pur, un linéaire avec du mannitol 1 %, un biréticulé et un linéaire 2,2 % avec niacinamide 1,5 % dans un même volume de 2 ml.
Les résultats ont montré que Innoryos® présentait le meilleur comportement fonctionnel global dans les paramètres expérimentaux retenus (adhésivité et pouvoir lubrifiant élevés et résistance sub-stantielle à la dégradation oxydative). À l’inverse, l’Ostenil® 1 % s’est avéré présenter des propriétés fonctionnelles moins intéressantes pour la viscosupplémentation que les autres produits étudiés.
Comme le soulignent les auteurs, une fois injecté, un viscosupplément se mélange au liquide synovial (LS). Il est donc essentiel d’examiner ses propriétés rhéologiques lorsqu’il est combiné à ce liquide synovial. En fonction de la formulation du produit, une fois que l’hydrogel est mélangé au LS, des propriétés spécifiques peuvent se dégrader à des rythmes différents et le système peut donc présenter des comportements et des effets distincts. L’incorporation d’un excipient antioxydant (par exemple, un polyol dans Ostenil® Plus et Happyvisc®) procure des avantages fonctionnels significatifs, notamment en ce qui concerne la dégradation liée au stress oxydatif (33, 39).
Des études cliniques comparatives sont donc nécessaires pour voir si ces propriétés se traduisent par une plus grande efficacité clinique.
Les polynucléotides
Les polynucléotides en injection intra-articulaire constituent, selon des études contrôlées, une alternative bien tolérée aux injections d’AH (40, 41). Ils ne sont pas disponibles en France.
Il existe des arguments expérimentaux sur une potentialisation des effets de l’AH injectable par des polynucléotides. Une étude clinique confirmerait cette potentialisation (42). Les résultats sur 2 ans ont suggéré qu’un cycle court de traitement intra-articulaire (trois injections hebdomadaires en double aveugle) avec des polynucléotides (propriétés de viscosupplémentation à longue durée d’action, activation des chondrocytes, propriétés de soulagement de la douleur) en combinaison fixe avec de l’AH de haut PM (PNHA) est plus efficace pour améliorer la fonction et la douleur chez les patients souffrant d’arthrose du genou que l’AH seul.
Le PNHA pourrait être choisi chez les patients souffrant d’arthrose du genou avec une douleur chronique et résistante sur arthrose évolutive.
Autres associations en expérimentation
Le clodronate et le diclofénac
D’autres associations à visée potentialisante ou synergique ont été essayées, notamment le clodronate et le diclofénac (43). L’étude préliminaire de 2013, qui montrait une efficacité supérieure de l’association AH + clodronate sur AH + diclofénac, devait déboucher sur des études complémentaires que l’on attend encore. En revanche, le clodronate seul en intra-articulaire a été utilisé récemment dans des arthroses résistantes à l’AH (44) avec une efficacité certaine et, semble-t-il, une bonne tolérance.
On ne saurait actuellement recommander de telles associations compte tenu du manque de preuves.
Le PRP
Des données expérimentales indiquent une possible synergie entre PRP et AH. Il existe actuellement un seul produit associant les deux dans un même kit (Regenmatrix®) et une étude contrôlée multicentrique est en cours en France dans des arthroses évoluées dont on attend les résultats avec impatience.
Pour l’heure, on ne peut recommander une telle association, le PRP étant proposé en cas de réponse insuffisante à l’AH, ce dernier ayant plus de recul, étant plus simple à injecter et moins onéreux. Dans quelques situations, le PRP pourrait être indiqué de préférence à l’AH comme nous le proposons dans l’algorithme (Fig. 3).
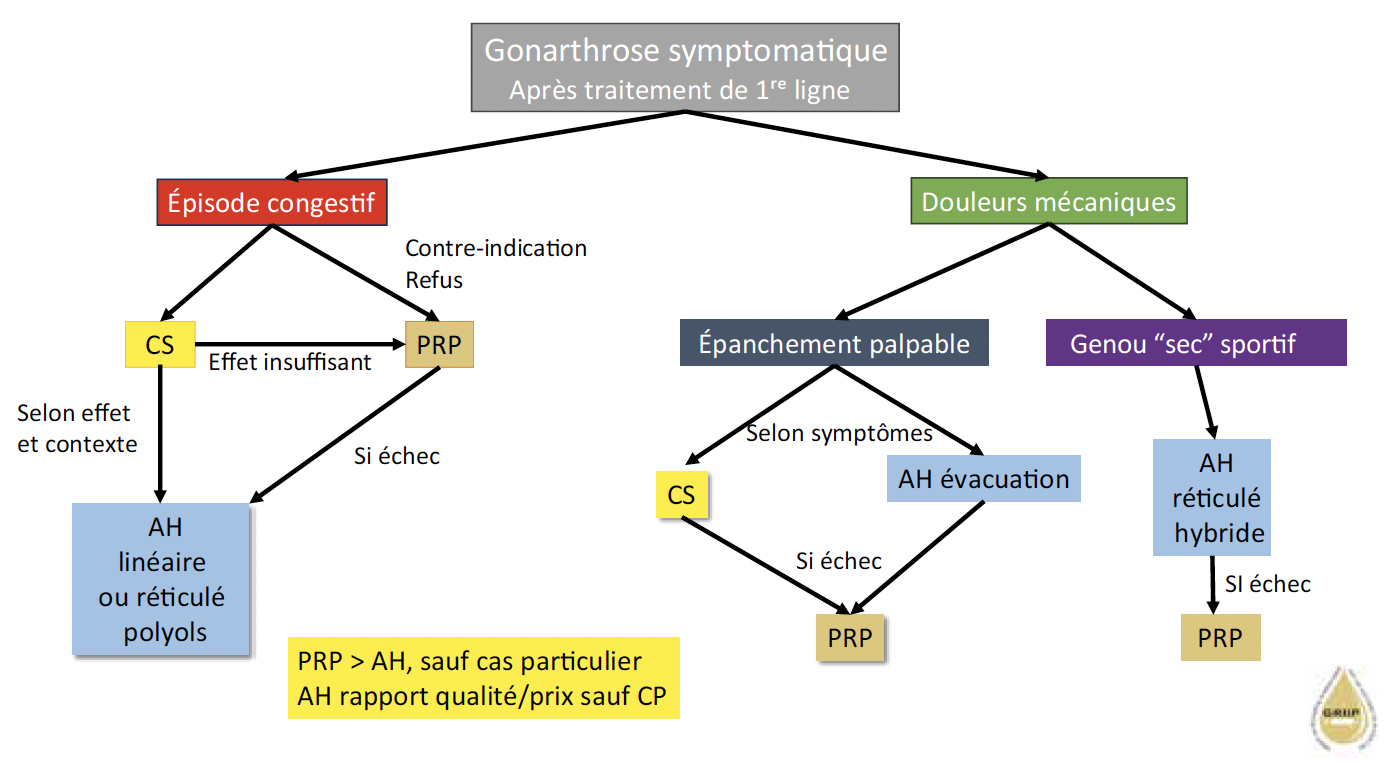
Figure 3 – Algorithme proposé (avis d’expert) des indications respectives de corticostéroïdes (CS), d’acide hyaluronique (AH) et de plasma riche en plaquettes (PRP) selon le phénotype clinique de la gonarthrose (CP = cas particulier).
Les différentes formes de réticulations (hydrogels chimiques et hybrides)
Un hydrogel est un gel dont l’agent gonflant est l’eau et dont la matrice est en général constituée par un réseau de polymères, macromolécules formées d’unités monomères liées entre elles par des liaisons covalentes. Ainsi, les molécules d’AH peuvent être agrégées autrement que par un procédé de réticulation chimique.
Les réticulés classiques
E. Balazs, pour obtenir un produit de viscosupplémentation de PM proche de celui du liquide synovial, soit environ 6 MDa, est passé par un procédé de réticulation qui est double dans le cas de l’hylane G-F 20, lequel contient une fraction (20 %) de bas PM et un AH réticulé de 6 MDa avec une concentration de 0,8 %, d’origine animale. Cette réticulation retarde la dégradation de l’AH et pourrait être apparentée à la cristallisation qui permet l’effet retard des corticoïdes locaux. D’autres procédés de simple réticulation ont été utilisés, donnant Happycross®, le HyaJoint® Plus et le Hyalexo Cross®. Une autre formulation plus ancienne et plus complexe a donné le NASHA (Non Animal Stabilized Hyaluronic Acid) ou Durolane® de PM estimé de 92 MDa dont les premières publications remontent à une vingtaine d’années (45, 46), suivies d’autres, plus récentes (47). Il a également fait l’objet d’études dans la hanche, l’épaule et la cheville. Il fait partie des AH injectables approuvés par la FDA.
Les complexes hybrides
À côté de divers procédés de réticulation, l’industrie a cherché d’autres procédés visant à améliorer la stabilité et prolonger le temps de résidence.
Jusqu’à récemment, on classait les AH en linéaires et en réticulés avec ou sans adjonction d’un polyol. Désormais, selon le type d’AH utilisé, on distingue trois catégories de formulations : l’AH linéaire, l’AH chimiquement modifié (dérivé ou réticulé) et les complexes hybrides AH HMW/LMW, c’est-à-dire contenant des bas et des hauts PM.
L’acide hyaluronique linéaire
La première catégorie comprend des solutions d’AH en milieu physiologique qui diffèrent en termes de concentration d’AH, de PM et de source comme on l’a vu plus haut.
L’acide hyaluronique chimiquement modifié
La deuxième catégorie se compose principalement d’hydrogels chimiques (pas de solutions) qui peuvent également contenir une certaine quantité de chaînes d’AH solubles dans l’eau (id Synvisc). À ce groupe appartiennent Hymovis® et d’autres nouveaux AH non disponibles en France (Jonexa®, Hyalastan® SGL 80).
Hymovis® est conçu selon le procédé MO.RE (Mobile Reticulum).
Les polymères linéaires d’AH, le HYADD4 en l’occurrence, sont stabilisés par des interactions hydrophobes et hydrophiles, formant un réticulum mobile (technologie MO.RE.) qui retrouve sa structure initiale même après des contraintes mécaniques répétées. Ce produit a fait déjà l’objet de plusieurs publications cliniques dans diverses localisations (48-51) et d’un commentaire sur l’efficacité d’un produit contenant finalement peu d’AH en poids comme on l’a vu plus haut (17).
Les complexes hybrides AH HMW/LMW
La dernière catégorie comprend les complexes physiques récemment développés, fondés sur des liaisons coopératives d’hydrogène entre des chaînes d’AH de tailles diverses (hybridation). C’est à cette catégorie qu’appartient le Sinovial® HL. Une étude randomisée contrôlée en double insu versus placebo montre une action rapide, dès la première semaine, se maintenant 24 semaines, significativement supérieure au placebo sur les critères principal et secondaires (52).
Une équipe italienne, La Gatta et al. (53), a étudié in vitro le comportement rhéologique de ces trois catégories d’AH, également après dilution et en présence de hyaluronidase, ainsi que leur bioactivité. Par rapport au produit linéaire non modifié à base d’AH, les échantillons chimiquement modifiés ont amélioré les performances mécaniques lors de sollicitations à haute fréquence et ont montré un effet de viscosupplémentation prolongé au détriment de la chimie naturelle du biopolymère (les molécules exogènes étant liées au biopolymère). Il a été démontré que les complexes hybrides d’AH conservaient le profil viscoélastique de la formule du premier groupe. En outre, en l’absence de modification chimique, ils ont présenté une stabilité comparable à celle de l’échantillon réticulé, ce qui suggère une action prolongée lorsqu’ils sont administrés dans les articulations pathologiques. La modulation des biomarqueurs liés à l’arthrose a été constatée pour toutes les formulations d’AH testées ; notamment, le troisième groupe a eu une action anti-inflammatoire marquée accompagnée d’une stimulation majeure de la hyaluronane synthase sur les chondrocytes et les synoviocytes humains.

Cet article est issu d’une présentation de la 2e journée internationale du GRIIP (9 février 2024).
Hervé Bard déclare des interventions ponctuelles, conseil scientifique, sans liens permanents, avec Labrha, Fidia, RegenLab, Nordic, Amgen ; et être membre du groupe EUROVISCO et président du GRIIP.
Thierry Conrozier déclare être consultant scientifique pour Labrha et consultant occasionnel et speaker pour Medac.
Bibliographie
1. Bannuru RR, Osani M, Vaysbrot EE, McAlindon TE. Comparative safety profile of hyaluronic acid products for knee osteoarthritis: a systematic review and network meta-analysis. Osteoarthritis Cartilage 2016 ; 24 : 2022-41.
2. Honvo G, Reginster JY, Rannou F et al. Safety of intra-articular hyaluronic acid injections in osteoarthritis: outcomes of a systematic review and meta-analysis. Drugs Aging 2019 ; 36 : 101-27.
3. Pereira TV, Juni P, Saadat P et al. Viscosupplementation for knee osteoarthritis: systematic review and meta-analysis. BMJ 2022 ; 378 : e069722.
4. Sellam J, Courties A, Eymard F et al. Recommendations of the French Society of Rheumatology on pharmacological treatment of knee osteoarthritis. Joint Bone Spine 2020 ; 87 : 548-55.
5. Oliva F, Marsilio E, Asparago G et al. The impact of hyaluronic acid on tendon physiology and its clinical application in tendinopathies. Cells 2021 ; 10 : 3081.
6. Frizziero A, Oliva F, Vittadini F et al. Efficacy of ultrasound-guided hyaluronic acid injections in achilles and patellar tendinopathies: a prospective multicentric clinical trial. mlTJ 2019 ; 9 : 305-13.
7. Abate M, Schiavone C, Salini V. The use of hyaluronic acid after tendon surgery and in tendinopathies. Biomed Res Int 2014 ; 2014 : 783632.
8. Raman R, Henrotin Y, Chevalier X et al. Decision algorithms for the retreatment with viscosupplementation in patients suffering from knee osteoarthritis: recommendations from the EUROpean VIScosupplementation COnsensus Group (EUROVISCO). Cartilage 2018 ; 9 : 263-75.
9. Conrozier T, Monfort J, Chevalier X et al. EUROVISCO recommendations for optimizing the clinical results of viscosupplementation in osteoarthritis. Cartilage 2020 ; 11 : 47-59.
10. Conrozier T, Raman R, Chevalier X et al. Viscosupplementation for the treatment of osteoarthritis. The contribution of EUROVISCO group. Ther Adv Musculoskelet Dis 2021 ; 13 : 1759720X211018605.
11. Henrotin Y, Tits C, Paul J et al. Retreatment with hyaluronic acid viscosupplementation in knee osteoarthritis: agreement between EUROVISCO guidelines and current medical practice. Cartilage 2021 ; 13 : 1696S-1701S.
12. Henrotin Y, Chevalier X, Raman R et al. EUROVISCO guidelines for the design and conduct of clinical trials assessing the disease-modifying effect of knee viscosupplementation. Cartilage 2018 : 11 : 60-70.
13. Peck J, Slovek A, Miro P et al. A comprehensive review of viscosupplementation in osteoarthritis of the knee. Orthop Rev 2021 ; 13 : 25549.
14. Zhang W, Doherty M, Arden N et al. EULAR evidence based recommendations for the management of hip osteoarthritis: report of a task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT). Ann Rheum Dis 2005 ; 64 : 669-81.
15. Bannuru RR, Osani MC, Vaysbrot EE et al. OARSI guidelines for the non-surgical management of knee, hip, and polyarticular osteoarthritis. Osteoarthritis Cartilage 2019 ; 27 : 1578-89.
16. Bruyere O, Honvo G, Veronese N et al. An updated algorithm recommendation for the management of knee osteoarthritis from the European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases (ESCEO). Semin Arthritis Rheum 2019 ; 49 : 337-50.
17. Conrozier T, Lohse T. Commentary: new viscoelastic hydrogel hymovis MORE single intra-articular injection for the treatment of knee osteoarthritis in sportsmen: safety and efficacy study results. Front Pharmacol 2021 ; 12 : 785074.
18. Calvet J, Khorsandi D, Tio L, Monfort J. Evaluation of a single-shot of a high-density viscoelastic solution of hyaluronic acid in patients with symptomatic primary knee osteoarthritis: the no-dolor study. BMC Musculoskelet Disord 2022 ; 23 : 442.
19. Altman RD, Bedi A, Karlsson J et al. Product differences in intra-articular hyaluronic acids for osteoarthritis of the knee. Am J Sports Med 2016 ; 44 : 2158-65.
20. Webner D, Huang Y, Hummer CD 3rd. Intraarticular hyaluronic acid preparations for knee osteoarthritis: are some better than others? Cartilage 2021 ; 13 : 1619S-36S.
21. Wu YZ, Huang HT, Ho CJ et al. Molecular weight of hyaluronic acid has major influence on its efficacy and safety for viscosupplementation in hip osteoarthritis: a systematic review and meta-analysis. Cartilage 2021 ; 13 : 169S-84S.
22. Balazs EA, Denlinger JL. Viscosupplementation: a new concept in the treatment of osteoarthritis. J Rheumatol Suppl 1993 ; 39 : 3-9.
23. Lindenhayn K, Heilmann HH, Niederhausen T et al. Elimination of tritium-labelled hyaluronic acid from normal and osteoarthritic rabbit knee joints. Eur J Clin Chem Clin Biochem 1997 ; 35 : 355-63.
24. Lindqvist U, Tolmachev V, Kairemo K et al. Elimination of stabilised hyaluronan from the knee joint in healthy men. Clin Pharmacokinet 2002 ; 41 : 603-13.
25. Larsen NE, Dursema HD, Pollak CT, Skrabut EM. Clearance kinetics of a hylan-based viscosupplement after intra-articular and intravenous administration in animal models. J Biomed Mater Res B Appl Biomater 2012 ; 100 : 457-62.
26. Boissier P, Mainil-Varlet P, Mautone GR. Increasing concentration of sinovial: effect on cartilage protection in a rabbit ACLT model. Cartilage 2021 ; 13 : 185S-95S.
27. Conrozier T. Is the addition of a polyol to hyaluronic acid a significant advance in the treatment of osteoarthritis? Curr Rheumatol Rev 2018 ; 14 : 226-30.
28. Conrozier T, Eymard F, Afif N et al. Safety and efficacy of intra-articular injections of a combination of hyaluronic acid and mannitol (HAnOX-M) in patients with symptomatic knee osteoarthritis: Results of a double-blind, controlled, multicenter, randomized trial. Knee 2016 ; 23 : 842-8.
29. Mendoza G, Alvarez AI, Pulido MM et al. Inhibitory effects of different antioxidants on hyaluronan depolymerization. Carbohydr Res 2007 ; 342 : 96-102.
30. Belda JI, Artola A, Garcia-Manzanares MD et al. Hyaluronic acid combined with mannitol to improve protection against free-radical endothelial damage: experimental model. J Cataract Refract Surg 2005 ; 31 : 1213-8.
31. Cavone L, Calosi L, Cinci L et al. Topical mannitol reduces inflammatory edema in a rat model of arthritis. Pharmacology 2012 ; 89 : 18-21.
32. Mongkhon JM, Thach M, Shi Q et al. Sorbitol-modified hyaluronic acid reduces oxidative stress, apoptosis and mediators of inflammation and catabolism in human osteoarthritic chondrocytes. Inflamm Res 2014 ; 63 : 691-701.
33. Conrozier T, Mathieu P, Rinaudo M. Mannitol preserves the viscoelastic properties of hyaluronic acid in an in vitro model of oxidative stress. Rheumatol Ther 2014 ; 1 : 45-54.
34. Cortet B, Lombion S, Naissant B et al. Non-inferiority of a single injection of sodium hyaluronate plus sorbitol to hylan G-F20: a 6-month randomized controlled trial. Adv Ther 2021 ; 38 : 2271-83.
35. Rivera F, Bertignone L, Grandi G et al. Effectiveness of intra-articular injections of sodium hyaluronate-chondroitin sulfate in knee osteoarthritis: a multicenter prospective study. J Orthop Traumatol 2016 ; 17 : 27-33.
36. Papalia R, Salini V, Voglino N et al. Single-dose intra-articular administration of a hybrid cooperative complex of sodium hyaluronate and sodium chondroitin in the treatment of symptomatic hip osteoarthritis: a single-arm, open-label, pilot study. Rheumatol Ther 2021 ; 8 : 151-65.
37. McCarty MF, Russell AL. Niacinamide therapy for osteoarthritis–does it inhibit nitric oxide synthase induction by interleukin 1 in chondrocytes? Med Hypotheses 1999 ; 53 : 350-60.
38. Jonas WB, Rapoza CP, Blair WF. The effect of niacinamide on osteoarthritis: a pilot study. Inflamm Res 1996 ; 45 : 330-4.
39. Porcello A, Hadjab F, Ajouaou M et al. Ex vivo functional benchmarking of hyaluronan-based osteoarthritis viscosupplement products: comprehensive assessment of rheological, lubricative, adhesive, and stability attributes. Gels 2023 ; 9 : 808.
40. Kim TW, Chang MJ, Shin CY et al. A randomized controlled trial for comparing efficacy and safety between intraarticular polynucleotide and hyaluronic acid for knee osteoarthritis treatment. Sci Rep 2023 ; 13 : 9419.
41. Vanelli R, Costa P, Rossi SM, Benazzo F. Efficacy of intra-articular polynucleotides in the treatment of knee osteoarthritis: a randomized, double-blind clinical trial. Knee Surg Sports Traumatol Arthrosc 2010 ; 18 : 901-7.
42. Stagni C, Rocchi M, Mazzotta A et al. Randomised, double-blind comparison of a fixed co-formulation of intra-articular polynucleotides and hyaluronic acid versus hyaluronic acid alone in the treatment of knee osteoarthritis: two-year follow-up. BMC Musculoskelet Disord 2021 ; 22 : 773.
43. Palmieri B, Rottigni V, Iannitti T. Preliminary study of highly cross-linked hyaluronic acid-based combination therapy for management of knee osteoarthritis-related pain. Drug Des Devel Ther 2013 ; 7 : 7-12.
44. Saviola G, Da Campo G, Bianchini MC et al. Intra-articular clodronate in patients with knee osteoarthritis non-responder to intra-articular hyaluronic acid – a case report series of 9 patients with 8-month follow-up. Clin Ter 2023 ; 174 : 245-8.
45. Altman RD, Akermark C, Beaulieu AD, Schnitzer T. Efficacy and safety of a single intra-articular injection of non-animal stabilized hyaluronic acid (NASHA) in patients with osteoarthritis of the knee. Osteoarthritis Cartilage 2004 ; 12 : 642-9.
46. Berg P, Olsson U. Intra-articular injection of non-animal stabilised hyaluronic acid (NASHA) for osteoarthritis of the hip: a pilot study. Clin Exp Rheumatol 2004 ; 22 : 300-6.
47. Leighton R, Fitzpatrick J, Smith H et al. Systematic clinical evidence review of NASHA (Durolane hyaluronic acid) for the treatment of knee osteoarthritis. Open Access Rheumatol 2018 ; 10 : 43-54.
48. Bernetti A, Agostini F, Alviti F et al. New viscoelastic hydrogel hymovis MO.RE. single intra-articular injection for the treatment of knee osteoarthritis in sportsmen: safety and efficacy study results. Front Pharmacol 2021 ; 12 : 673988.
49. Migliore A, Frediani B, Gigliucci G et al. Efficacy of a single intra-articular HYMOVIS ONE injection for managing symptomatic hip osteoarthritis: a 12-month follow-up retrospective analysis of the ANTIAGE register data. Orthop Res Rev 2020 ; 12 : 19-26.
50. Henrotin Y, Bannuru R, Malaise M et al. Hyaluronan derivative HYMOVIS(R) increases cartilage volume and type ii collagen turnover in osteoarhritic knee: data from MOKHA study. BMC Musculoskelet Disord 2019 ; 20 : 293.
51. Perticarini L, Baldari A, Bruzzone M et al. Hymovis MO.RE. in the treatment of knee and ankle chondropathy in elite athletes: preliminary results of the CHAMPS (Cohort study about HYADD4-G Administration for Pain relief on Soccer players) prospective clinical study. Eur Rev Med Pharmacol Sci 2021 ; 25 : 6356-64.
52. Migliore A, Blicharski T, Plebanski R et al. Knee osteoarthritis pain management with an innovative high and low molecular weight hyaluronic acid formulation (HA-HL): a randomized clinical trial. Rheumatol Ther 2021 ; 8 : 1617-36.
53. La Gatta A, Stellavato A, Vassallo V et al. Hyaluronan and derivatives: an in vitro multilevel assessment of their potential in viscosupplementation. Polymers 2021 ; 13 : 3208.
54. Hummer CD, Angst F, Ngai W et al. High molecular weight Intraarticular hyaluronic acid for the treatment of knee osteoarthritis: a network meta-analysis. BMC Musculoskelet Disord 2020 ; 21 : 702.
55. Migliore A, Maheu E, Saccone L et al. What we should expect from an innovative intra-articular hyaluronic acid product: expert opinion based on a comprehensive review of the literature. J Clin Med 2023 ; 12 : 74-22.




