L’essentiel en un clin d’œil
Pour cet Eular 2025, je vous ai sélectionné mon top 5 avec quatre études thérapeutiques et l’une concernant les vaccins.
• Dans l’étude MyJIA, les auteurs ont évalué l’intérêt de réaliser des synoviorthèses en même temps que l’introduction d’un anti-TNF.
• La couverture vaccinale est une préoccupation importante dans l’AJI, dont l’apparition précoce, les fausses croyances et les traitements immunosuppresseurs utilisés pour la contrôler peuvent interférer avec le respect du calendrier vaccinal établi et augmenter le risque d’infections à l’âge adulte, une étude a fait le point sur cette couverture lors de la transition.
• Enfin, trois études concernent la maladie de Still et ses traitements (anti-IL-1, JAK Inhibiteurs et syndrome d’activation macrophagique).
TOP 1 – AJI, synoviorthèse et anti-TNF : quelle utilité à tout faire en même temps ?
Boyesen P et al. nous ont présenté les résultats de l’étude MyJIA, dont l’objectif était un peu surprenant pour des rhumatologues, puisqu’il s’agissait d’évaluer l’efficacité d’injections intra-articulaires d’hexacétonide de triamcinolone dans l’arthrite juvénile non systémique lors de l’instauration d’un traitement par anti-TNF, comparativement à l’instauration sans synoviorthèse. En moyenne 60 % des AJI bénéficient d’un traitement par anti-TNF et les synoviorthèses sont utilisées comme traitement adjuvant avec une excellente efficacité. Cependant, aucune étude n’a évalué cette efficacité lors de l’instauration d’un traitement de fond.
L’étude MyJIA
Il s’agit donc d’une étude ouverte, randomisée, de phase IV, dont l’évaluateur était en aveugle de la procédure, réalisée dans plusieurs centres en Norvège. Furent inclus des patients âgés de 1-18 ans, commençant un anti-TNF et dont une ou plusieurs articulations pouvaient bénéficier d’une synoviorthèse à l’hexacétonide de triamcinolone. La randomisation 1:1 distribuait les patients en deux groupes, avec ou sans synoviorthèse entre la semaine 0 et 24.
L’objectif primaire était d’avoir une maladie inactive aux semaines 24 et 36, celle-ci étant définie selon les critères ACR et associés à l’absence d’utilisation de corticoïdes de la semaine 20 à 36. Les objectifs secondaires étaient le temps jusqu’à l’obtention d’une maladie inactive, les taux de réponse ACR30 et le score JADAS, ainsi que la qualité de vie des patients, la douleur et bien sûr la tolérance.
Le calcul d’échantillons réalisé sur une hypothèse d’une différence de 20 % entre les groupes (45 % de maladie inactive dans le groupe synoviorthèse versus 25 % dans l’autre groupe) prévoyait donc l’inclusion de 176 patients.
Les patients
Au total, 188 patients ont été randomisés, alloués au groupe injection (n = 92) et sans injection (n = 96). Les deux populations n’étaient pas différentes statistiquement, âgées en moyenne de 10,5 ans, 63 % de filles, majoritairement des formes oligoarticulaires étendues ou persistantes, ou alors des polyarthrites séronégatives, environ 3 % de rhumatismes psoriasiques ainsi que 9 et 14 % d’arthrites avec enthésites. La grande majorité (87 et 84 %) avaient du méthotrexate. Le nombre d’articulations actives était de 3 (5 %) dans le groupe avec synoviorthèse et de 2 (4 %) dans le groupe sans injection.
Résultats
Concernant l’objectif primaire d’une maladie inactive aux semaines 24 et 36, il était atteint par 35 % des patients du groupe injection et par 33 % du groupe sans injection (RR = 2 % ; p = 0,80). Le temps pour atteindre une maladie inactive a été similaire entre les deux groupes, de 184 jours dans le groupe synoviorthèse et de 188 dans le groupe sans injection (p = 0,54).
Tolérance
Concernant la tolérance, 6 (7 %) d’événements indésirables graves ont été rapportés dans le groupe injection et 8 (8 %) dans le groupe sans injection. Les événements les plus fréquents étaient les infections respiratoires hautes, 30 (22%) dans le groupe avec injection et 24 (25 %) dans le groupe sans injection. Des atrophies sous-cutanées ont été retrouvées chez 8 (9 %) des patients du groupe injection. Il n’y a eu aucune arthrite septique.
En pratique
Cette étude a donc montré que les injections d’hexacétonide de triamcinolone, lorsqu’elles sont réalisées en même temps que l’instauration d’un anti-TNF ne permettent pas d’obtenir plus rapidement une maladie inactive. La qualité de vie rapportée par les patients a été identique dans les deux groupes ainsi que les résultats des critères ACR30. Il ne s’agit donc pas d’une bonne stratégie et mieux vaut réserver les synoviorthèses a un autre moment de la prise en charge, ce que font d’ailleurs la plupart des rhumatologues.
• Boyesen P, Aga AB, Lilleby V et al. Treatment efficacy of intra-articular triamcinolone hexacetonide injections in juvenile idiopathic arthritis patients starting tumor necrosis factor inhibitor therapy: results from a randomized, open-label, blinded-assessor, multicenter phase 4 trial – the MyJIA trial. Eular 2025 ; OP0208.
TOP 2 – Les patients vus par le rhumatologue lors de la transition ont-ils une bonne couverture vaccinale ?
Il est recommandé dans l’AJI d’assurer une bonne couverture vaccinale de nos patients afin de diminuer les risques d’événements infectieux. L’objectif de cette étude était d’évaluer le degré de conformité au calendrier vaccinal espagnol avant la consultation de transition en rhumatologie et d’analyser les différents facteurs pouvant influencer sa mise en œuvre.
L’étude
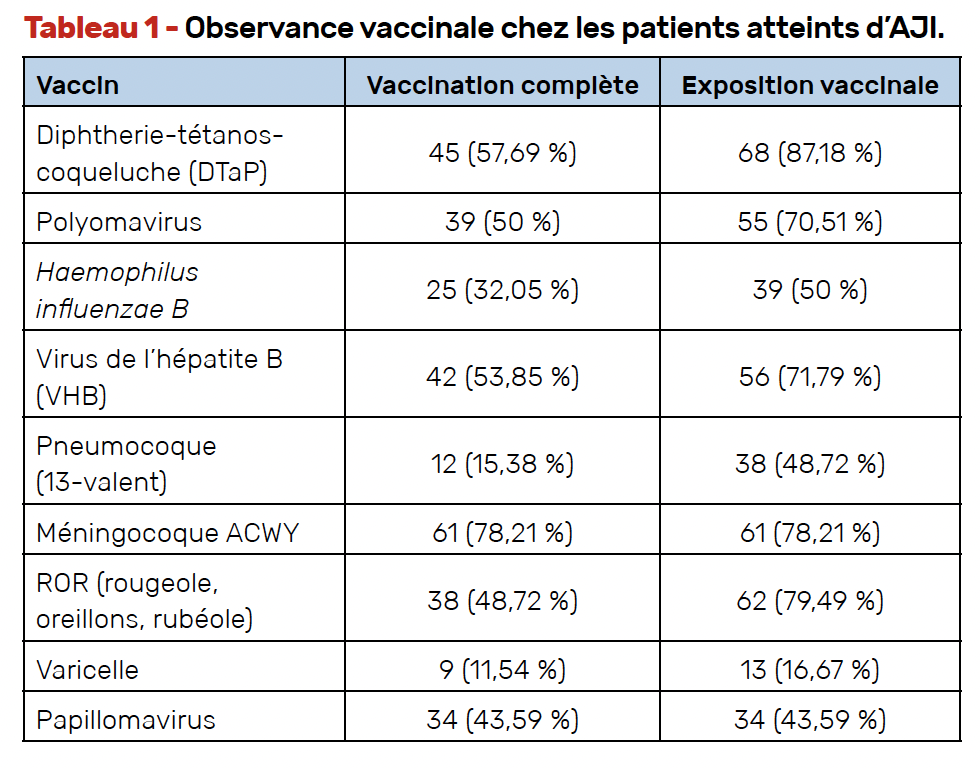
Il s’agit d’une étude observationnelle rétrospective monocentrique portant sur des patients atteints d’AJI (critères ILAR 2001) inclus dans le registre de consultation de transition en rhumatologie entre 2012 et 2024, à Valence, en Espagne. Les données cliniques, thérapeutiques et vaccinales ont été recueillies. Étant donné la variabilité du calendrier vaccinal durant la période de suivi, il a été décidé d’inclure les vaccins contre le virus de l’hépatite B (VHB), le polyomavirus, Haemophilus influenzae B, la diphtérie-tétanos-polio (DTaP), le pneumocoque (13-valent), le méningocoque ACWY, le papillomavirus, la varicelle et le ROR (rougeole, oreillons et rubéole).
Les principales données recueillies étaient :
• traitement par biomédicaments (DMARDs biologiques) ou DMARDs classiques,
• nombre d’années d’exposition aux DMARDs biologiques,
• âge au moment du diagnostic
• et date de la consultation de transition.
L’exposition vaccinale a été définie comme l’administration d’au moins une dose de vaccin, et la vaccination complète comme la réalisation de toutes les doses prévues dans le calendrier vaccinal de la Communauté valencienne. Des modèles de régression logistique ont été utilisés pour étudier la relation entre les différentes variables et l’observance vaccinale.
Les patients
Ainsi, 78 AJI (64,1 % de filles) ont été inclus, d’âge moyen 8,7 ans (4-7) ans au moment du diagnostic et de 20,8 ans (2-7) ans lors de la consultation de transition en rhumatologie. Il s’agissait d’AJI oligoarticulaires (28 %), d’arthrites avec enthésite (24 %), de formes polyarticulaires RF négatif (20,5 %), de Still (9 %), de formes polyarticulaires RF+ (6,5 %), indifférenciées (6,5 %) et psoriasiques (5 %). 52,6 % des patients avaient été traités par DMARDs biologiques et 40 % par DMARDs classiques.
Résultats
Un seul patient avait reçu la totalité des doses de tous les vaccins recommandés, et cinq au moins une dose de chacun. Le tableau 1 présente le pourcentage d’observance pour chaque vaccin. L’analyse multivariée a montré que la durée du traitement biologique était associée à une plus faible exposition aux vaccins ROR (p = 0,045), DTaP (p = 0,019) et polyomavirus (p = 0,015), ainsi qu’à une plus faible vaccination complète contre le polyomavirus (p = 0,04), le papillomavirus (p = 0,008) et le VHB (p = 0,03). Le traitement par DMARDs classiques était associé à une plus grande exposition aux vaccins pneumococcique (p = 0,001) et VHB (p = 0,012). Enfin, bonne nouvelle, une date plus récente de consultation de transition était liée à un taux plus élevé de vaccination complète contre Haemophilus influenzae B (p < 0,001), le pneumocoque (p = 0,022) et la varicelle (p = 0,038).
En pratique
Encore une fois, cette étude montre le faible pourcentage d’exposition vaccinale, et en particulier de couverture vaccinale complète dans l’AJI, notamment lors de l’utilisation de biologiques. En revanche, le méthotrexate est associé à une meilleure couverture vaccinale contre le pneumocoque et le VHB. L’observance s’est améliorée ces dernières années.
• Perez Hurtado A, Ivorra Cortés J, Grau Garcia E et al. Analysis of vaccination compliance in patients with juvenile idiopathic arthritis at the rheumatology transitional consultation. Eular 2025 ; ABS0254.
TOP 3, 4, 5 – Trois études ont mis en lumière la maladie de Still et ses options thérapeutiques
Le firsékibart
La première étude dans la maladie de Still concernait l’utilisation du firsékibart. Il s’agit en fait d’une étude de phase II, ouverte, chinoise, multicentrique, randomisée d’efficacité et de tolérance. Le firsékibart (qui a changé de nom entre la soumission des abstracts et la présentation, puisqu’il s’appelait le génakumab) est un anti-IL-1ß développé par une entreprise pharmaceutique chinoise (Changchun Genescience), équivalent du canakinumab, de type IGG4, administré par voie sous-cutanée et qui bloque donc la fixation de l’IL-1ß à son récepteur. Pour mémoire, l’IL-1ß est secrétée par les monocytes/macrophages activés et joue un rôle important dans la cascade inflammatoire.
L’étude
Des enfants atteints d’AJI systémique active (plus de deux arthrites, une CRP ≥ 30 mg/l et une fièvre quotidienne documentée ≥ 38 °C depuis ≥ 3 jours au cours de la dernière semaine) étaient randomisés en trois groupes (R =1:1:1) pour recevoir :
• soit l’anticorps monoclonal 3 mg/kg en sous-cutané toutes les 4 semaines,
• soit 4 mg/kg en sous-cutané toutes les 4 semaines,
• soit du tocilizumab 8 ou 12 mg/kg en IV toutes les 2 semaines selon le poids du patient.
L’objectif primaire était la proportion de patients atteignant le critère de réponse ACR pédiatrique 30 au jour 28, et les critères secondaires étaient ACRped 50/70/90 ainsi que les données de tolérance.
Les patients de la semaine 5 à 24 étaient suivis concernant le maintien de la réponse puis, de S25 à S28, entraient dans la période de suivi au long cours.
Au total, 50 patients sont entrés dans l’étude (n = 17 firsékibart 3 mg, n = 16 firsékibart 4 mg, n = 16 tocilizumab). Les trois groupes étaient similaires à l’inclusion.
Résultats
Après 28 jours de traitement, il n’y avait pas de différence entre les trois groupes de traitement en ce qui concerne l’efficacité (Fig. 1). Dans le groupe firsékibart 3 mg, le taux de réponse en ACR30 était de 94,1 (16/17 patients) à J28 ; l’efficacité était comparable à celle du tocilizumab pour les deux doses de firsékibart. Il en était de même pour les critères secondaires avec, pour la dose firsékibart 3 mg, des critères ACRpe 50 atteints dans 76,5 % des cas, ACRPe 70 dans 64,7 % et ACRped 90 dans 47,1 %. La dose de 3 mg faisait toujours un peu mieux que celle de 4 mg.
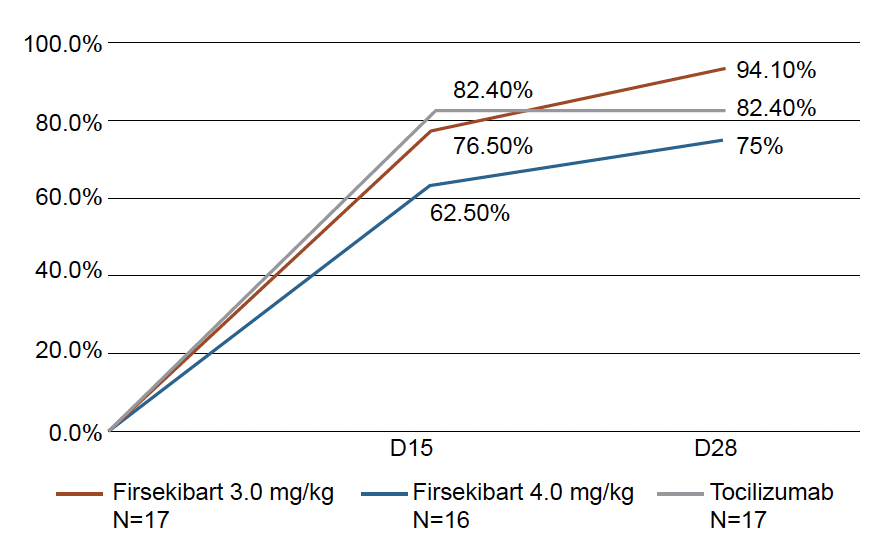
Figure 1 – Critères d’efficacité ACR pédiatrique 30 du firsékibart comparativement au tocilizumab dans la maladie de Still active.
Concernant la tolérance jusqu’au jour 28, des infections des voies respiratoires hautes ont été rapportées.
En pratique
Ces résultats vont probablement amener à poursuivre le développement de cette molécule chinoise.
Le tofacitinib
La seconde étude thérapeutique concernant la maladie de Still avait pour objectif d’évaluer l’efficacité du tofacitinib dans la maladie de Still active. Ruperto N et al. nous ont présenté les résultats d’une étude multicentrique, randomisée, de phase III. Le tofacitinib est un inhibiteur oral des janus kinases utilisé dans le traitement des AJI de formes polyarticulaires et dans la forme psoriasique. Une première étude de phase III avait évalué l’efficacité du tofacitinib chez des patients sans atteinte systémique active.
L’étude
L’objectif de cette étude a été d’évaluer l’efficacité et la tolérance du tofacitinib dans les AJI actives. L’activité était définie comme la présence au screening d’une VS > 30 mm/h et de soit :
• ≥ 2 articulations avec une arthrite au screening et à l’inclusion, des hyperthermies > 38 °C durant plus de 1 jour lors du screening et au cours de la première semaine avant la première administration de tofacitinib ;
• ≥ 5 synovites au screening et à l’inclusion.
Les patients âgés de 2-17 ans ont été inclus et ont reçu au cours d’une première phase du tofacitinib 5 mg, deux fois par jour (ou un équivalent poids s’ils pesaient moins de 40 kg) pendant 16 semaines avec une dose stable de corticoïdes. Puis, les patients atteignant un critère de réponse d’activité 50 (JIAS-ACR50) entraient dans la phase 2 de la semaine 16 à 24 et diminuaient les corticoïdes selon un schéma pré-établi. À la semaine 24, si les patients avaient atteint ces objectifs, ils entraient enfin dans la phase randomisée, en double aveugle, d’évaluation de la rechute à l’arrêt des traitements : 50 % poursuivaient le tofacitinib et 50 % étaient alors sous placebo.
Les patients
Au total, 100 patients ont été inclus dans la phase 1 et 59 seulement sont entrés dans la phase randomisée, 28 dans le groupe tofacitinib (14 sont restés sans poussée) et 31 dans le groupe placebo (11 sont restés sans poussée). Les patients étaient âgés en moyenne de 10 ans (7-13), 56 % de garçons, 65 % avaient de la fièvre, 40 % des rashs cutanés et une moyenne de six arthrites (5-13). Le JADAS-27 CRP était de 24 (20-30).
Résultats
À l’entrée dans la phase randomisée (tofacitinib 28 et placebo 31), aucun patient n’avait de fièvre et dans le groupe tofacitinib seuls 10,7 % avaient encore un rash (0 % dans le groupe placebo). Enfin, la CRP était quasiment normalisée. L’objectif primaire était le temps de la poussée, mais l’étude n’a pas atteint ce critère puisque le temps de la poussée n’a pas été statistiquement différent entre le groupe randomisé pour poursuivre le tofacitinib et celui sous placebo. Le temps médian de rechute était de 295 jours dans le bras placebo et non évaluable dans le groupe tofacitinib. Le pourcentage de patients présentant une poussée était de 39,3 % dans le groupe tofacitinib et de 54,8 % dans le groupe placebo.
Tolérance
Dans les phases ouvertes, les événements graves sous tofacitinib étaient au nombre de huit chez sept participants (trois poussées de Still, un syndrome d’activation macrophagique (SAM), une lymphadénite nécrosante considérée ensuite comme un SAM, un lymphome de Hodgkin atypique, une dépression, une overdose (même patient que la dépression)).
En pratique
L’étude est donc négative sur le schéma et les objectifs proposés par les auteurs malgré des premiers résultats publiés positifs et une efficacité qui semblait partiellement intéressante chez un certain nombre de patients concernant les rashs et la fièvre.
L’émapalumab
Et pour finir, Grom A et al. nous ont présenté les résultats d’analyse poolés de deux études prospectives concernant l’efficacité et la tolérance de l’émapalumab dans le traitement du SAM de la maladie de Still.
Les études
Les deux études étaient interventionnelles, ouvertes, de bras unique chez des patients présentant un SAM ne répondant pas à de fortes doses de corticoïdes. Initialement pédiatrique, l’étude EMERALD (NCT 03311854) a été étendue aux patients ayant eu un Still débutant à l’âge adulte après les résultats préliminaires très encourageants initiaux. En résumé, les patients présentant un SAM ne répondant pas aux glucocorticoïdes ou s’aggravant selon l’avis de l’investigateur sur les paramètres cliniques et/ou biologiques étaient inclus. Ils bénéficiaient d’un traitement par émapalumab (6 mg/kg en IV), puis, des jours 4-16, de 3 mg/kg tous les 3 jours, puis, des jours 17-28, de 3 mg/kg deux fois par semaine.
L’efficacité était évaluée à la semaine 8 et les patients suivis ensuite 52 semaines. Les critères d’inclusion étaient d’avoir un diagnostic de SAM confirmé par le rhumatologue :
• patients fébriles avec une ferritine > 684 ng/ml
• et deux critères parmi : taux de plaquettes ≤ 181 x 109/l, ASAT > 48 U/l, triglycérides > 156 mg/dl, fibrinogène ≤ 360 ng/dl, ainsi qu’une réponse inadéquate à de fortes doses de glucocorticoïdes IV administrées pendant au moins 3 jours.
En revanche, tous les patients ayant un diagnostic de SAM secondaire à une néoplasie ou primitif étaient exclus, ainsi que les patients traités simultanément par canakinumab, JAK inhibiteurs, anti-TNF, tocilizumab, étoposide, anakinra < 4 mg/kg/j au moment de l’initiation de l’émapalumab.
Le critère d’évaluation était composite : absence de SAM clinique (EVA ≤ 1 cm et taux de ferritine diminué de 80 % comparativement à l’inclusion et < 2 000 ng/ml, LDH, ASAT, ALAT < 1,5 fois la norme, normalisation des plaquettes et leucocytes, fibrinogène > 100 mg/dl). Les huit critères devaient être remplis à la semaine 8 pour être considéré en rémission complète.
Résultats
Au total, 39 patients ont été inclus (14 dans la première étude et 25 dans EMERALD), âgés en moyenne de 12 ans (0,8-64), 79 % de femmes, majoritairement d’origine européenne.
Le taux de rémission à la semaine 8 était de 53,8 % (IC 95 % =37,2-69,9), soit 21/39 patients et respectivement de 71,4 % (IC 95 % = 41,9-91,6) dans la première étude et 44 % (IC 95 % = 24,4-65,1) dans EMERALD. La première réponse complète était observée au dixième jour. Quasiment tous les patients ont normalisé leur taux de LDH. La figure 2 montre le temps médian de normalisation des paramètres biologiques en semaine et la figure 3, la baisse des corticoïdes. L’interféron gamma a bien été neutralisé par l’émapalumab comme attesté par les taux de CXCL9.
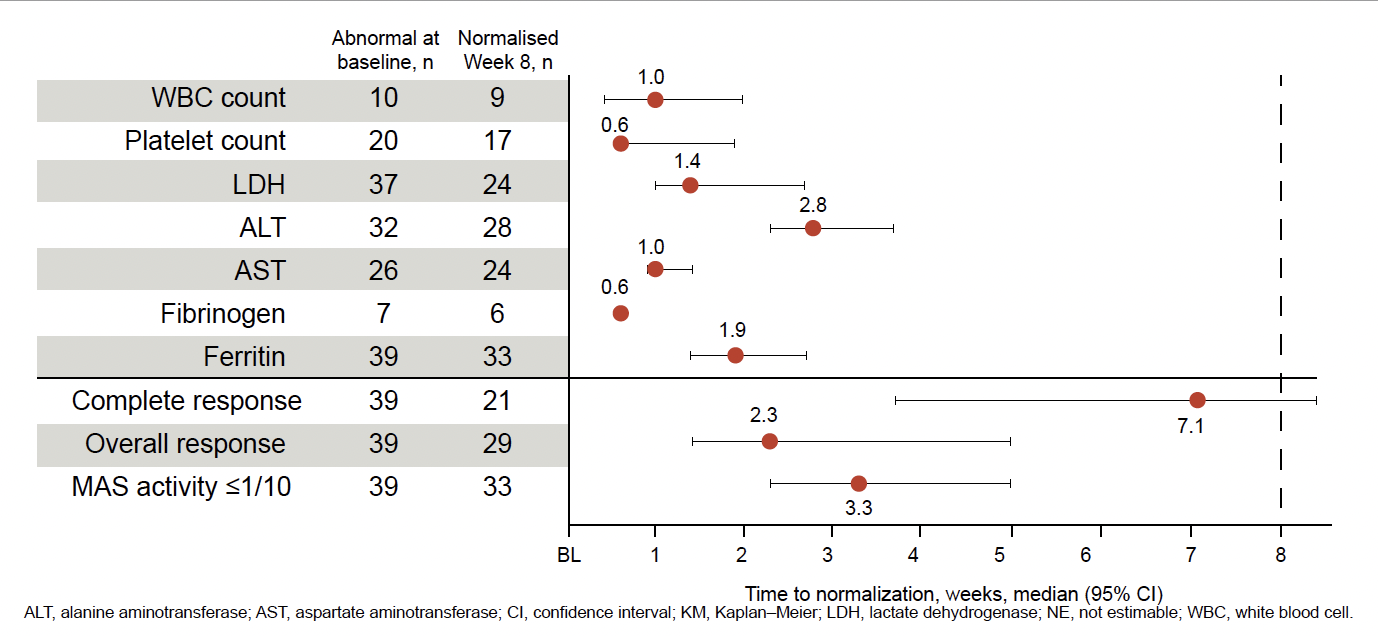
Figure 2 – Temps médian de normalisation des paramètres biologiques dans le SAM.
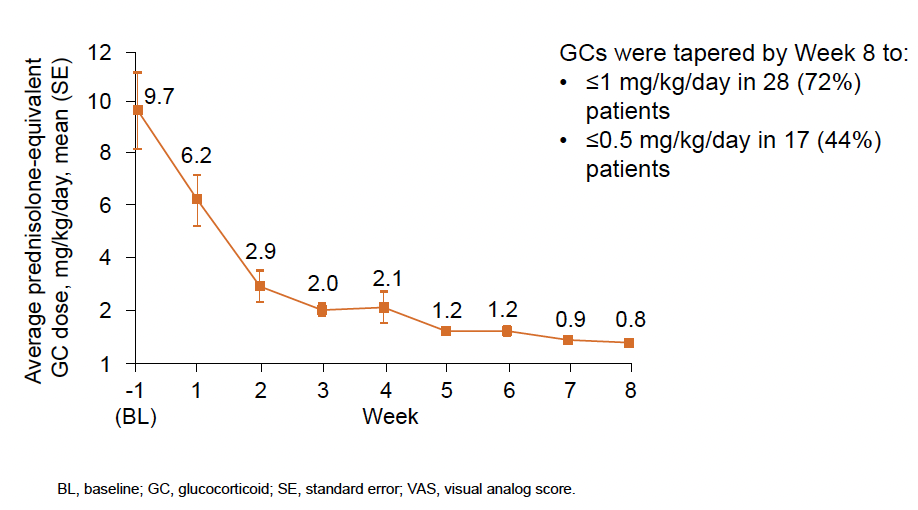
Figure 3 – Diminution de la dose de corticoïdes.
Tolérance
Deux patients sont décédés au cours de l’étude EMERALD, aucun dans la première étude à recrutement uniquement pédiatrique. Au total, 41 % des patients ont présenté des événements indésirables liés à l’émapalumab, dont 2,6 % ont amené à l’arrêt du traitement. Quatre patients ont présenté des effets secondaires sévères liés au traitement. Huit ont présenté des réactions à la perfusion, mais n’empêchant pas la poursuite du traitement, 10 % des infections virales peu sévères.
En pratique
En poolant ces deux études, 53,6 % des patients étaient en rémission complète à la semaine 8 et, si l’on excluait le taux de LDH, ils étaient 69 %. Les symptômes étaient contrôlés dans 84,6 % des cas et 72 % des patients ont pu diminuer les corticoïdes à une dose ≤ 1 mg/kg/j à la semaine 8. L’émapalumab est donc un traitement intéressant et efficace des formes sévères de SAM.
• Li C, Zhang J, Yu H et al. Efficacy and safety of genakumab in active systemic juvenile idiopathic arthritis (sJIA): a multicenter, randomized, open-label phase 2 clinical study. Eular 2025 ; OP0206.
• Ruperto N, Brunner HI, Synoverska O et al. Tofacitinib in juvenile idiopathic arthritis: a double-blind, placebo-controlled, withdrawal phase 3 randomised trial. LanceT 2021 ; 398 : 1984-96.
• Ruperto N, LiC, Chinniah K et al. Efficacy and safety of tofacitinib in patients with active systemic juvenile idiopathic arthritis. Eular 2025 ; OP0212.
• De Benedetti F, Grom A, Brigan PA et al. Efficacy and safety of emapalumab in macrophage activation syndrome. Ann Rheum Dis 2023 ; 82 : 857-65.
• Grom A, Ullman U, Mahmood A et al. Efficacy and safety of emapalumab in patients with macrophage activation syndrome in still’s disease: results from a pooled analysis of two prospective trials. Eular 2025 ; OP0207.
Valérie Devauchelle-Pensec déclare avoir des liens d’intérêt avec Abbvie, Biocon, BMS, Chugaï, Fresenius-Kabi, Galapagos, Lilly, MSD, Novartis, UCB (interventions ponctuelles et/ou intérêts indirects).




