Introduction
Le tissu adipeux (TA) a longtemps été considéré comme un organe représenté essentiellement par le tissu adipeux blanc ayant pour principale fonction le stockage des lipides. Son rôle métabolique, surtout connu chez les petits animaux hibernant, semblait alors se limiter au TA brun considéré comme anecdotique et non fonctionnel chez l’homme après la période fœtale. Ce TA brun, riche en mitochondries assurant l’oxydation des acides gras et conférant la couleur brune caractéristique (cytochromes), est pourtant un acteur essentiel de la balance énergétique, spécialisé dans la thermogenèse induite par l’alimentation.
La connaissance du TA a beaucoup évolué ces 20 dernières années. On sait maintenant que le TA blanc est composé de deux types de tissus adipeux avec des rôles bien distincts : stockage pour le TA sous-cutané (80 %) et métabolique pour le TA viscéral (10-20 %) fortement associé aux maladies cardiovasculaires et aux troubles métaboliques. Les progrès de l’imagerie fonctionnelle dans les années 2000 ont permis l’identification d’un TA brun fonctionnel dans la région cervicale le long du rachis, en péri-rénal et à proximité des gros vaisseaux permettant une diffusion optimale de la chaleur, ou même encore au sein du TA blanc (adipocytes beiges).
La recherche autour du TA continue d’évoluer. Le TA apparaît de plus en plus comme un organe dynamique capable de sécréter, d’interagir avec d’autres tissus, capable aussi de s’adapter et de modifier sa composition. Il devient un acteur physiopathologique au cours bien sûr de l’obésité mais aussi des rhumatismes inflammatoires chroniques de l’arthrose, de l’ostéoporose, du vieillissement et évidemment du Covid-19… et pourquoi pas un jour un agent thérapeutique !
Le tissu adipeux : un organe endocrine
Les adipokines
Le TA blanc représente 15 à 25 % du poids corporel. Il est organisé en lobules constitués d’adipocytes dotés de fonctions protéiques et enzymatiques capables d’assurer le transport et le stockage des lipides en période postprandiale et de les réutiliser (lipolyse) entre les repas pour fournir de l’énergie. Il a une activité sécrétoire intense avec la libération de plus de 50 molécules actives (hormones, protéines, lipides) regroupées sous le terme d’adipokines ou adipocytokines. Ces molécules vont réguler le métabolisme énergétique, lipidique, la prise alimentaire, la sensibilité à l’insuline, la réponse immunitaire, la fonction vasculaire, l’hémostase, le remodelage et l’expansion du TA. Elles sont produites majoritairement par les adipocytes mais peuvent également être produites par d’autres cellules : immunitaires, synoviocytes, ostéoblastes ou chondrocytes par exemple.
Les adipokines peuvent avoir une activité pro-inflammatoire ou anti-inflammatoire. Un déséquilibre de cette balance adipocytokinique vers une inflammation de bas grade est considéré comme caractéristique de l’obésité et pourrait faire le lien avec d’autres pathologies chroniques également associées aux désordres cardiométaboliques, dont les rhumatismes inflammatoires et l’arthrose.
Parmi les adipokines pro-inflammatoires, on peut citer la leptine, induite par l’inflammation et corrélée à la masse grasse qui agit sur la différenciation des lymphocytes TH1 et TH17, les lymphocytes B, les macrophages, l’angiogenèse. La chémérine initialement identifiée dans les lésions cutanées de psoriasis possède des propriétés chémo-attractantes et est impliquée dans la signalisation de l’insuline. La résistine et la visfatine augmentent l’insulinorésistance et sont associées à une élévation des triglycérides et du LDL cholestérol. L’oncostatine M est impliquée dans l’athérosclérose, les maladies cardiovasculaires, l’insuffisance cardiaque et la thrombose.
À l’opposé, l’adiponectine joue un rôle anti-inflammatoire protecteur en améliorant la sensibilité à l’insuline, en réduisant la production d’IL-6 et de TNF-α et les marqueurs de stress oxydatif. Elle est considérée comme protectrice sur les cellules endothéliales, réduit les triglycérides et augmente le HDLc. L’adiponectine est diminuée au cours de l’obésité et est inversement corrélée à l’IMC. L’omentine et l’apeline sont d’autres adipokines anti-
inflammatoires induisant la production d’adiponectine. La relaxine exerce de nombreux effets cardiovasculaires favorables en raison de ses propriétés anti-fibrotiques, cicatrisantes, vasodilatatrices, angiogéniques. D’autres adipokines d’identification plus récentes ont aussi un profil anti-inflammatoire. C’est le cas par exemple du FGF-21 ou de météorine-like.
En plus des adipocytes, le TA contient d’autres cellules telles que les fibroblastes, pré-adipocytes, cellules inflammatoires, cellules endothéliales, et les cellules progénitrices, capables d’activités sécrétoires. Les macrophages du TA sont responsables de la majorité des sécrétions du TA. Les adipokines et les vésicules adipocytaires extracellulaires sont impliquées dans la polarisation de ces macrophages soit vers un phénotype proinflammatoire M1 (IL-1, IL-6, IL-12, IL-23, TNF-α), soit vers un phénotype anti-inflammatoire M2 (IL-10, IL-1RA, TGF-β).
Les gouttelettes lipidiques, exosomes
En plus des cytokines et adipokines, l’adipocyte peut relarguer, à partir de corps vésiculaires contenus dans le cytoplasme, des vésicules extracellulaires dites exosomes. Ces vésicules adipocytaires extracellulaires contiennent des molécules protéiques, lipidiques, des micro-ARN, bioactifs et les transportent jusqu’à l’organe cible permettant ainsi une communication inter-organe à distance avec les cellules immunitaires, le foie, le pancréas, le muscle, le cerveau… Des anomalies dans la quantité de microvésicules relarguées mais aussi dans leur composition pourraient rendre compte des comorbidités associées à l’excès de TA. Ainsi, ces exosomes selon leur composition et leur site de production, peuvent affecter la sensibilité à l’insuline, la polarisation des macrophages, l’oxydation des lipides, l’adipogenèse, l’appétit. Des modifications de ces microvésicules ont déjà été observées au cours de l’obésité, du diabète, de la stéato-hépatite non alcoolique, des lipodystrophies (1). Elles pourraient dans le futur être utilisées non seulement comme des biomarqueurs de santé accessibles dans la circulation périphérique mais également comme des agents thérapeutiques. Ainsi, l’administration d’exosomes isolés de la graisse brune ou du sérum de souris non mutées améliore la sensibilité à l’insuline et le profil lipidique d’un modèle de souris insulinorésistantes. En plus d’utiliser les exosomes circulants endogènes comme agent thérapeutique, il semble possible d’en modifier le contenu et la cible. Il est par exemple possible d’appauvrir les exosomes en micro-RNA impliqués dans l’inflammation métabolique et la résistance à l’insuline.
Le tissu adipeux au cours de l’obésité
L’obésité est caractérisée par des modifications importantes du TA. S’il existe une hypertrophie des adipocytes, leur expansion est limitée, ce qui diminue les capacités de stockage et conduit à la libération d’acides gras libres dans la circulation et à leur dépôt dans des organes non prévus à cet effet (foie, cœur, muscle). Ces dépôts ectopiques d’acide gras sont responsables d’un mécanisme de lipotoxicité qui aggrave l’insulinorésistance.
Un déséquilibre dans la production d’adipokines et de cytokines pro-inflammatoires et anti-inflammatoires est responsable d’un état inflammatoire de bas grade affectant le métabolisme du glucose et des lipides. Cette inflammation de bas grade contribue aux altérations morphologiques, de remodelage et in fine de capacités de stockage des adipocytes du TA mais également sur les autres systèmes cellulaires et régulateurs (Fig. 1).
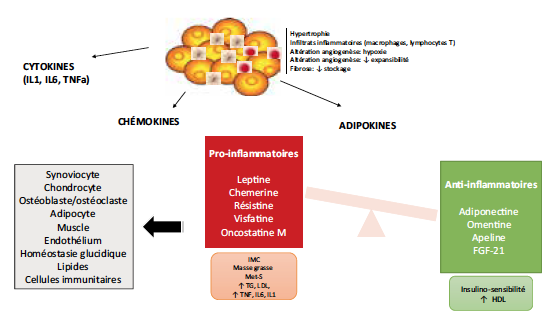
Figure 1 – Tissu adipeux au cours de l’obésité : altérations morphologiques, déséquilibre entre adipo-cytokines pro et anti-inflammatoires et conséquences sur les grandes fonctions cellulaires et régulatrices.
Obésité et rhumatismes inflammatoires
L’inflammation chronique systémique au cours des rhumatismes inflammatoires chroniques affecte aussi le TA, sa répartition, sa qualité, son profil sécrétoire. Inversement, l’obésité et le TA influencent la réponse inflammatoire et immunitaire au cours des rhumatismes inflammatoires, que ce soit l’effet des traitements ou à un stade plus précoce et aux phases précliniques de la maladie. L’obésité est associée à une inflammation de bas grade et à la production de cytokines pro-inflammatoires qui peuvent aggraver les pathologies auto-immunes et les comorbidités associées.
Au cours de la PR et des SpA, 55 à 60 % des patients sont en surpoids ou obèses contre environ 40 % des contrôles sains appariés (2). Cela peut même atteindre 75 % au cours du rhumatisme psoriasique. L’obésité est associée à des comorbidités plus fréquentes : syndrome métabolique, diabète de type 2, stéato-hépatite non alcoolique, hypertension artérielle, dyslipidémie, événements cardiovasculaires.
Bien que l’obésité et la masse grasse soient fortement liées aux troubles métaboliques, le lien entre indice de masse corporelle (IMC) et syndrome métabolique diffère entre PR et SpA. Dans la PR, le syndrome métabolique est plus fréquent chez les patients non obèses et n’est pas associé à la composition corporelle en masse grasse contrairement aux SpA (2).
Deux méta-analyses ont confirmé une association positive entre l’obésité et le risque de survenue de PR et un effet « dose » de l’IMC en particulier chez les femmes et les PR séronégatives (3, 4). Même si les données sont moins nombreuses, l’obésité est aussi associée à une augmentation du risque de rhumatisme psoriasique (5).
Une activité plus élevée et une moins bonne réponse aux biothérapies, en particulier les anti-TNF, sont observées au cours de l’obésité (6). Néanmoins, si les PR obèses ont des scores DAS28 et une altération de la qualité de vie plus importants, elles ont moins de progression structurale surtout en présence de FR ou d’anti-CCP. La perte de poids par réduction calorique ou chirurgie bariatrique améliore l’activité de la PR, du rhumatisme psoriasique ou du psoriasis et la réponse thérapeutique (7). Plusieurs études ont rapporté une diminution de la réponse aux anti-TNF chez les patients obèses alors qu’il ne semble pas exister de différence pour l’abatacept, le tocilizumab, le rituximab, les anti-IL-17 (8).
Le tissu adipeux au cours des rhumatismes inflammatoires
Le TA est encore peu étudié au cours des rhumatismes inflammatoires chroniques bien que nombre de données maintenant s’accordent sur une altération de la composition corporelle, et sur une augmentation de la masse grasse au détriment de la masse maigre et ce, de façon précoce au cours de la maladie (9, 10).
On dispose de quelques données sur modèle animal d’arthrite au collagène. L’induction d’une arthrite au collagène chez la souris entraîne des modifications circulantes (insulinosensibilté, production de leptine) et du TA (expression de TNF et d’IL-1,
leptine, infiltrat macrophagique) d’autant plus importantes que les souris sont aussi obèses (11). Chez ces animaux, un traitement par méthotrexate ou hydroxychloroquine (HCQ) diminue les taux circulants de TNF et d’IL1 et leur expression dans le TA mais seule l’HCQ diminue le poids, les taux de leptine circulante, et améliore l’insulinorésistance.
De nombreuses études dans la PR se sont intéressées aux adipokines qui peuvent être produites localement par les synoviocytes mais aussi par les ostéoclastes, ostéoblastes et chondrocytes (12). Les adipokines comme les cytokines constituent un réseau très complexe aux fonctionnalités diverses et sont capables d’interagir les unes avec les autres, ce qui rend difficile l’identification d’un effet spécifique dans un environnement multifactoriel tel que la PR. Les taux sériques de chémérine et de visfatine sont augmentés dans la PR avec une plus grande spécificité pour la chémérine. La visfatine et la résistine ont une incidence sur la viabilité des chondrocytes.
Le rôle de l’adiponectine n’est pas complétement éclairci au cours de la PR. Avec des effets parfois opposés dans les articulations, elle pourrait avoir localement un effet pro-
inflammatoire et induire des dégâts structuraux. La leptine sérique et l’adiponectine normalisées à la masse grasse sont augmentées dans la PR par rapport aux témoins sains.
Dans le rhumatisme psoriasique (13), une élévation des taux sériques d’adiponectine, résistine, visfatine est observée mais sans corrélation avec les niveaux d’activité. Leptine et adiponectine sont plus élevées dans le rhumatisme psoriasique que dans le psoriasis.
Dans la SA, une élévation de la résistine et de la visfatine est rapportée sans corrélation aux scores d’activité ou de fonction. Il n’a pas été noté de différence pour la leptine par rapport à des sujets sains. La visfatine pourrait être associée à une progression structurale au rachis.
Effet des traitements sur le TA
Un effet spécifique des traitements de fond sur la composition corporelle est difficile à démontrer. Il n’existe pas ou très peu d’études contrôlées et randomisées. Par ailleurs, la composition corporelle est très liée à la balance énergétique qui varie en fonction de nombreux facteurs dont l’activité physique et l’alimentation, rarement prise en compte dans les critères d’évaluation ou d’ajustement.
L’obtention d’une rémission ou d’une faible activité par des traitements de fond conventionnels améliore la composition corporelle (masse maigre et masse grasse) mais ne permet pas de normaliser celle-ci par rapport à des sujets contrôles (9). La corticothérapie aggrave l’obésité et le pourcentage de masse grasse (14). Dans la PR, deux essais randomisés de faible effectif ne montrent pas de différence de masse maigre et de masse grasse après 6 mois de traitement entre les groupes anti-TNF et méthotrexate, mais il existe une augmentation de la masse grasse à 2 ans dans le groupe anti-TNF (9). Deux études observationnelles sous anti-IL-6 montrent une augmentation de la masse maigre sans augmentation de la masse grasse à 1 an (9). Une étude observationnelle à 1 an ne montre pas de variation de la masse grasse sous biothérapie ou traitement conventionnel et retrouve une augmentation de la masse maigre sous anti-TNF (9). L’effet bénéfique de l’hydroxychloroquine sur le risque cardiovasculaire, l’insulinosensibilité et le syndrome métabolique est suggéré dans plusieurs études (15).
Obésité et arthrose
L’obésité et l’arthrose ont en commun une inflammation de bas grade. L’obésité est l’un des facteurs de risque bien connu de l’arthrose, à la fois comme facteur mécanique des articulations portantes (hanches, genoux) mais aussi comme facteur métabolique en raison d’un effet systémique des adipokines (gonarthrose, arthrose digitale, rachis lombaire). Cette arthrose métabolique est associée au syndrome métabolique et à la surmortalité cardiovasculaire (16). Le syndrome métabolique est aussi un facteur de sévérité et de mauvais pronostic favorisant la progression structurale. Il existe à la fois un effet cumulatif de l’obésité (poids) et de chaque composant du syndrome métabolique (obésité abdominale, HTA, insulinorésistance, dyslipidémie), mais également un effet indépendant du diabète de type 2, de la dyslipidémie, et de l’HTA. La physiopathologie implique la production par le TA d’adipokines et des cytokines et aussi de radicaux libres oxygénés, d’acides gras libres ou encore de lipoprotéines circulantes oxydées (oxLDL). De nombreuses études sur les modèles murins de souris obèses démontrent une inflammation synoviale marquée qui précède les lésions cartilagineuses. Une augmentation de la leptine et visfatine est observée dans le sang, le liquide articulaire, les chondrocytes des patients arthrosiques. In vitro, elles ont un effet pro-inflammatoire et délétère sur des synoviocytes et chondrocytes. À l’inverse, l’expression des récepteurs à l’adiponectine est diminuée dans les chondrocytes arthrosiques pouvant suggérer une résistance à l’adiponectine qui elle-même a un effet anti-inflammatoire protecteur. Certains acides gras saturés ou libre produits en excès lors d’un régime occidental peuvent activer synoviocytes et chondrocytes via les TLR4, être responsables d’une lipotoxicité lors de dépôts ectopiques dans le muscle ou le foie et augmenter l’insulinorésistance et la sarcopénie. Enfin, la dysbiose intestinale pourrait aussi faire le lien entre arthrose et syndrome métabolique.
Conclusion
Le TA reste encore mal connu et la graisse bien-mal aimée. Il est pourtant partout. C’est un organe endocrine à part entière qui participe aux fonctions essentielles, qui communique via les adipokines et qui peut même voyager grâce aux exosomes. Il est donc complexe à appréhender, à explorer mais nous ouvre de nouvelles perspectives physiopathologiques et certainement thérapeutiques. À suivre…
L’auteur déclare ne pas avoir de lien d’intérêt.
Bibliographie
1. Huang Z, Xu A. Adipose Extracellular Vesicles in Intercellular and Inter-Organ Crosstalk in Metabolic Health and Diseases. Front Immunol 2021 ; 12 : 608680.
2. Giraud C. The relationship between weight status and metabolic syndrome in patients with rheumatoid arthritis and spondyloarthritis. Joint Bone Spine 2021 ; 88 : 105059.
3. Qin B, Yang M, Fu H et al. Body mass index and the risk of rheumatoid arthritis: a systematic review and dose-response meta-analysis. Arthritis Res Ther 2015 ; 17 : 86. doi:10.1186/s13075-015-0601-x
4. Feng J, Chen Q, Yu F et al. Body Mass Index and Risk of Rheumatoid Arthritis: A Meta-Analysis of Observational Studies. Medicine (Baltimore) 2016 ; 95 : e2859. doi:10.1097/MD.0000000000002859
5. Xie W, Huang H, Deng X et al. Modifiable lifestyle and environmental factors associated with onset of psoriatic arthritis in patients with psoriasis: A systematic review and meta-analysis of observational studies. J Am Acad Dermatol 2021 ; 84 : 701–11. doi:10.1016/j.jaad.2020.08.060
6. Daïen CI, Sellam J. Obesity and inflammatory arthritis: impact on occurrence, disease characteristics and therapeutic response. RMD Open 2015 ; 1 : e000012. doi:10.1136/rmdopen-2014-000012
7. Di Minno MND, Peluso R, Iervolino S, et al. Weight loss and achievement of minimal disease activity in patients with psoriatic arthritis starting treatment with tumour necrosis factor α blockers. Ann Rheum Dis 2014 ; 73 : 1157-62. doi:10.1136/annrheumdis-2012-202812
8. Shan J, Zhang J. Impact of obesity on the efficacy of different biologic agents in inflammatory diseases: A systematic review and meta-analysis. Joint Bone Spine 2019 ; 86 : 173-83. doi:10.1016/j.jbspin.2018.03.007
9. Letarouilly J-G, Flipo R-M, Cortet B et al. Body composition in patients with rheumatoid arthritis: a narrative literature review. Ther Adv Musculoskelet Dis 2021 ; 13 : 1759720X211015006. doi:10.1177/1759720X211015006
10. Turk SA, van Schaardenburg D, Boers M et al. An unfavorable body composition is common in early arthritis patients: A case control study. PLOS ONE 2018 ; 13 : e0193377. doi:10.1371/journal.pone.0193377
11. Arias de la Rosa I, Escudero-Contreras A, Ruiz-Ponce M et al. Molecular Changes in the Adipose Tissue Induced by Rheumatoid Arthritis: Effects of Disease-Modifying Anti-Rheumatic Drugs. Front Immunol 2021 ; 12 : 744022. doi:10.3389/fimmu.2021.744022
12. Neumann E, Hasseli R, Ohl S et al. Adipokines and Autoimmunity in Inflammatory Arthritis. Cells 2021 ; 10. doi:10.3390/cells10020216
13. Neumann E, Junker S, Schett G et al. Adipokines in bone disease. Nat Rev Rheumatol 2016 ; 12 : 296-302. doi:10.1038/nrrheum.2016.49
14. Konijn NPC, van Tuyl LHD, Boers M et al. The short-term effects of two high-dose, step-down prednisolone regimens on body composition in early rheumatoid arthritis. Rheumatology 2016 ; kew221. doi:10.1093/rheumatology/kew221
15. Mathieu S, Pereira B, Tournadre A et al. Cardiovascular effects of hydroxychloroquine: a systematic review and meta-analysis. Ann Rheum Dis Published Online First: 7 December 2017. doi:10.1136/annrheumdis-2017-212668
16. Courties A, Berenbaum F, Sellam J. The Phenotypic Approach to Osteoarthritis: A Look at Metabolic Syndrome-Associated Osteoarthritis. Joint Bone Spine 2019;86:725–30. doi:10.1016/j.jbspin.2018.12.005




