Risque par rapport à la population générale et associé aux traitements
Le cancer, première cause de mortalité en France, touche particulièrement les patients atteints de polyarthrite rhumatoïde (PR), avec un risque global accru de 20 %. Tabac, inflammation chronique et traitements sont autant de facteurs potentiellement impliqués. Ce risque reste toutefois variable selon le type de cancer.
Résumé
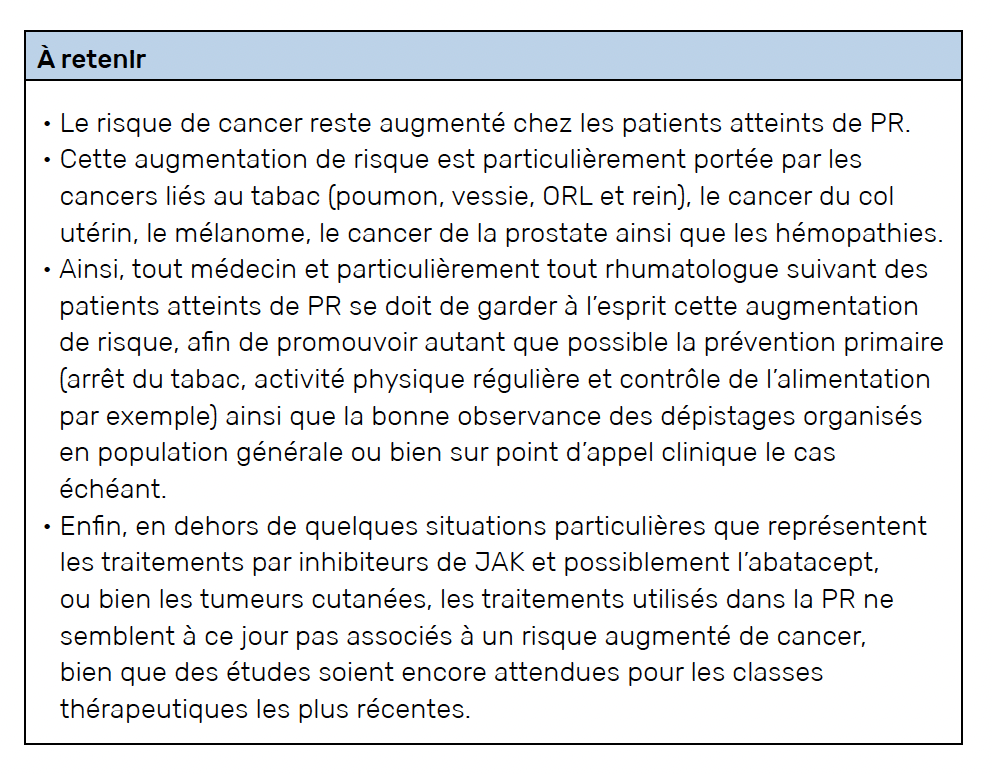
Le cancer est la première cause de mortalité en France et son incidence sur la santé des patients reste majeure. La polyarthrite rhumatoïde (PR) est associée à une augmentation globale du risque de cancer (+20 % par rapport à la population générale), en particulier des cancers liés au tabac (poumon, vessie, rein, ORL), du col de l’utérus et des mélanomes. En revanche, une diminution du risque de cancer du sein, de l’endomètre et du pancréas est observée. Concernant les cancers hématologiques, la PR est associée à un risque accru, notamment pour les lymphomes et le myélome. Cette augmentation du risque d’hémopathie pourrait être diminuée grâce aux progrès récents dans la prise en charge de la PR.
L’effet des traitements sur le risque de cancer varie. Les anti-TNF ont été étroitement surveillés, et ne sont pas associés à un surrisque global de cancer, sauf potentiellement pour les tumeurs cutanées non mélanomes. Les inhibiteurs de JAK, notamment le tofacitinib, ont été montrés comme associés à un risque accru de cancer. Pour l’abatacept, une légère augmentation du risque de cancers cutanés et urinaires est possible. Les données concernant le tocilizumab et le rituximab restent limitées.
Compte tenu de l’augmentation du risque de cancer, les médecins doivent sensibiliser les patients atteints de PR à la prévention primaire (arrêt du tabac, activité physique) et aux dépistages organisés en population générale.
Abstract
Cancer risk in rheumatoid arthritis
Cancer is the leading cause of mortality in France, significantly impacting patients’ health, particularly in the context of rheumatoid arthritis (RA). RA is associated with an overall increased cancer risk (+20% compared to the general population), especially for tobacco-related cancers (lung, bladder, kidney, ENT), cervical cancer, and melanoma. Conversely, a decreased risk of breast, endometrial, and pancreatic cancers has been observed.
Regarding hematological cancers, RA is linked to an increased risk, notably for lymphomas or myeloma. This risk may be mitigated by recent advances in RA management.
The impact of treatments on cancer risk varies. Anti-TNF therapies, while closely monitored, are not associated with an overall increased cancer risk, except potentially for non-melanoma skin cancers. JAK inhibitors, particularly tofacitinib, have been shown to increase cancer risks. For abatacept, a slight increase in the risk of skin and urinary cancers is possible. Data on tocilizumab and rituximab remain limited.
Given the elevated cancer risk, physicians should educate RA patients about primary prevention (e.g., smoking cessation, physical activity) and encourage adherence to general population cancer screening programs.
Introduction
Le cancer est aujourd’hui la première cause de mortalité en France, avec une incidence majeure sur la santé et l’espérance de vie des patients atteints, et ce, malgré les progrès thérapeutiques récents.
Les facteurs de risque de cancer sont multiples et varient grandement selon les cancers considérés. On peut citer parmi les plus connus le tabac, l’alcool, l’obésité, l’alimentation ou les rayonnements ultra-violets. Les maladies inflammatoires chroniques peuvent également augmenter le risque de certains cancers, tels que la maladie de Sjögren au cours de laquelle le risque de lymphome est multiplié par dix (1). Enfin, certains traitements peuvent également augmenter le risque de cancer probablement par altération de l’immunité anti-tumorale, l’exemple incontestable récent est celui des inhibiteurs de JAK dans l’essai ORAL Surveillance (2).
Les patients atteints de PR sont à l’intersection de ces trois risques : le tabac est un facteur de risque de PR, la PR est responsable d’inflammation chronique et les patients sont exposés de manière prolongée à des traitements immunosuppresseurs. Nous allons dans cette mise au point aborder le risque de cancer global et par site, chez les patients atteints de PR par rapport à la population générale, ainsi que le rôle potentiel des traitements.
Risque de cancer au cours de la polyarthrite rhumatoïde par rapport à la population générale
Cancers solides
Dès 2007, une étude populationnelle (3) mettait en évidence une augmentation du risque de certains cancers tels que le mélanome, le poumon et, à l’inverse, un sous-risque de cancer du sein et du côlon.
Le cancer du poumon
L’augmentation du risque de cancer du poumon a par la suite été retrouvée dans de nombreuses études (4, 5), résultat non surprenant compte tenu du fait que le tabac est un facteur de risque partagé à ces deux maladies.
Les cancers cutanés
L’augmentation du risque de cancer cutané a par la suite été débattue, car non retrouvée dans plusieurs études populationnelles (5-7), alors que le risque de tumeurs cutanées non mélanome semble bien être augmenté au cours de la PR (7).
Le cancer du côlon
De manière intéressante, le sous-risque de cancer du côlon retrouvé dans les études anciennes n’est quant à lui pas retrouvé ultérieurement. L’une des hypothèses soulevées par cette disparition d’un effet apparemment protecteur de la PR vis-à-vis de ce cancer est l’évolution de l’arsenal thérapeutique ayant entraîné une forte réduction de la consommation d’anti-inflammatoires non stéroïdiens.
Le cancer du sein
Enfin, si l’on évoque le cas du cancer du sein, les patientes atteintes de PR semblent moins à risque que la population générale, comme ceci a été confirmé dans une étude suédoise à ce sujet (8). Cette diminution de risque était constante au cours du temps, aussi bien avant qu’après le diagnostic de PR, et indépendante des expositions hormonales, suggérant ainsi un possible facteur génétique protecteur vis-à-vis du cancer du sein, mais pouvant augmenter le risque de PR.
Les données françaises
Bien que de nombreuses études aient été réalisées au cours des 15 dernières années, les populations étudiées étaient parfois limitées, par la taille du pays dans le cas des études populationnelles suédoises, ou par la taille des registres dans les études britanniques. Ainsi, nous avons réalisé une étude sur les données françaises de l’Assurance maladie afin d’obtenir une précision d’estimation du risque de cancer au cours de la PR par rapport à la population générale jusqu’à présent inédite (9), en incluant plus de 250 000 patients atteints de PR avec une durée de suivi médiane de plus de 8 ans. Le détail du risque de cancer global et site spécifique est présenté dans la figure 1. Comme dans les études citées jusqu’à présent, les analyses n’étaient ajustées que sur l’âge, le sexe et l’année calendaire.
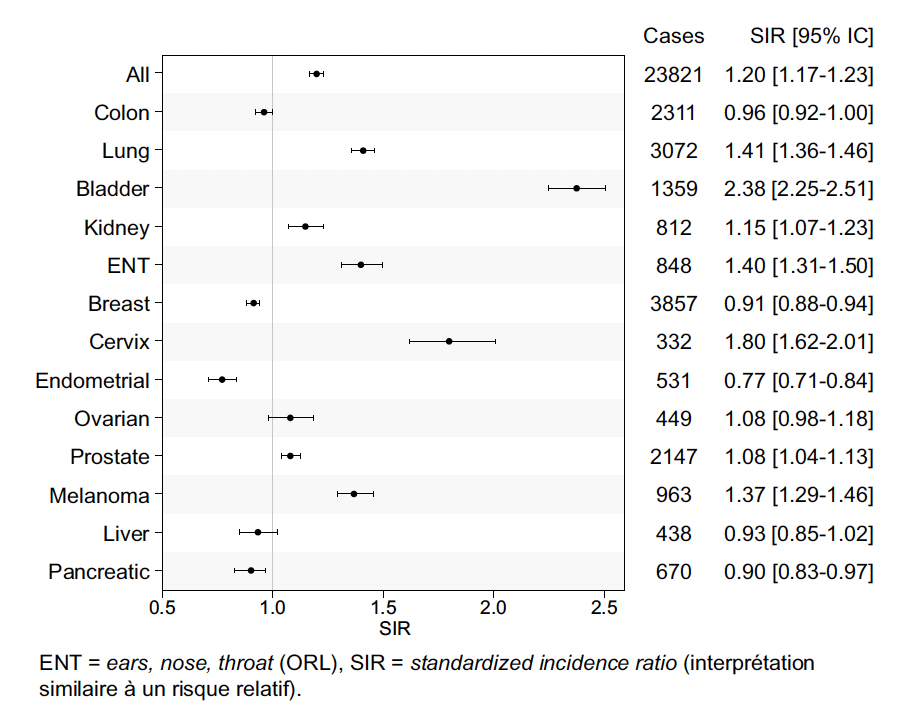
Figure 1 – Risque de cancer tout site et cancers solides au cours de la polyarthrite rhumatoïde par rapport à la population générale (9).
Nous avons confirmé le risque augmenté de cancer global de l’ordre de 20 % dans la PR par rapport à la population générale, avec une hausse des cancers liés au tabac (poumon, mais également vessie, rein et ORL), ainsi qu’une augmentation du risque de dysplasie de haut grade ou de cancer du col de l’utérus, du risque de mélanome et faiblement d’un risque de cancer de la prostate. À l’inverse, nous avons confirmé une diminution du risque de cancer du sein, et mis en évidence de manière inédite une diminution du risque de cancer de l’endomètre et du pancréas. N’étaient pas incluses dans cette étude les tumeurs cutanées non mélanome.
Cancers hématologiques
La stimulation chronique du système immunitaire peut avoir pour conséquence la sélection de clones pouvant à terme évoluer vers un lymphome. L’exemple le plus illustratif de ce mécanisme physiopathologique est la maladie de Sjögren. Il semble qu’un phénomène similaire puisse exister dans la PR, cependant dans une moindre mesure. L’étude de 2007 citée précédemment faisait état d’un risque augmenté de 80 % par rapport à la population générale, estimation confirmée par une étude robuste récente (10), sans pour autant distinguer les sous-types de lymphome en question.
Ce risque par rapport à la population générale par sous-type de lymphome est présenté dans la figure 2, à partir de notre étude fondée sur l’Assurance maladie (9). Il s’avère que les hémopathies les plus fréquentes étaient le lymphome B diffus à grandes cellules et le myélome. Les hémopathies voyant leur risque le plus augmenté étaient le lymphome de Hodgkin, le lymphome folliculaire et le lymphome B diffus à grandes cellules.
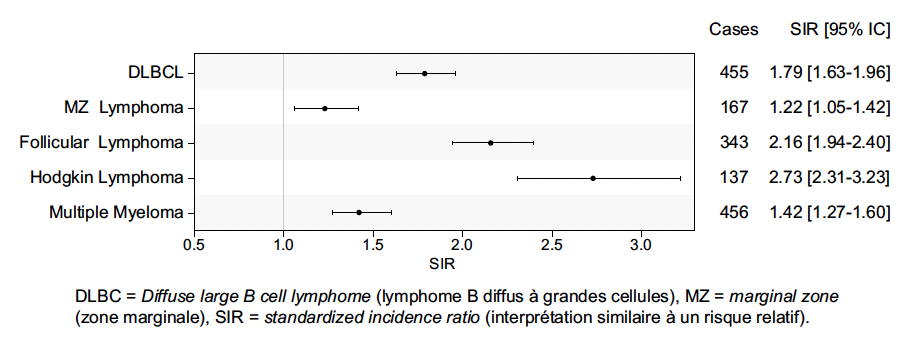
Figure 2 – Risque de cancer hématologique au cours de la polyarthrite rhumatoïde par rapport à la population générale (9).
L’inflammation chronique liée à la PR a été associée au risque de lymphome (11). De manière intéressante, nous avons mis en évidence que cette augmentation de risque était plus faible sur la période 2016-2020 que 2010-2015 pour les lymphomes de la zone marginale et folliculaire, suggérant que l’amélioration de la prise en charge de la PR au cours de la dernière décennie pourrait diminuer ce risque d’hémopathies médié par l’inflammation chronique. Ce risque décroissant au court du temps a également été mis en évidence par une équipe suédoise (12).
Ainsi, bien que le risque de cancer global soit augmenté de l’ordre de 20 % dans la PR par rapport à la population générale, ce risque est inhomogène selon le type de cancer, reflétant probablement des mécanismes oncogéniques différents.
Risque de cancer associé aux traitements
Naturellement, compte tenu du risque augmenté de cancer dans la PR, et de la prudence généralisée vis-à-vis du risque attribuable aux traitements immunosuppresseurs, de nombreuses études post-commercialisation se sont intéressées à l’association entre cancer et biothérapies. Il faut rappeler qu’à l’exception d’une étude toutes sont observationnelles et qu’il n’est ainsi pas garanti que les éventuelles associations retrouvées entre l’exposition à un traitement et la survenue de cancer soient causales.
Les anti-TNF
Étant la biothérapie la plus ancienne du marché et dont le nom même fait craindre une augmentation du risque de cancer, il s’agit de la classe thérapeutique ayant bénéficié du plus d’études à ce sujet dans la PR.
Risque global
Malgré des premiers signaux inquiétants fondés sur une méta-analyse d’essais randomisés (13) quant au risque global de cancer et l’exposition aux anti-TNF, de nombreuses études populationnelles robustes n’ont pas retrouvé de risque global de cancer augmenté (4, 7, 14) en comparaison aux patients sous DMARDs conventionnels. Voire, certaines études retrouvent un sous-risque (15), mais celles-ci sont possiblement sujettes à des biais de sélection. Dans une étude française sur les données de l’Assurance maladie ayant inclus près de 16 000 patients atteints de PR débutant un traitement par anti-TNF, nous n’avions pas retrouvé de risque augmenté de cancer global ni site spécifique (16) (Fig. 3).
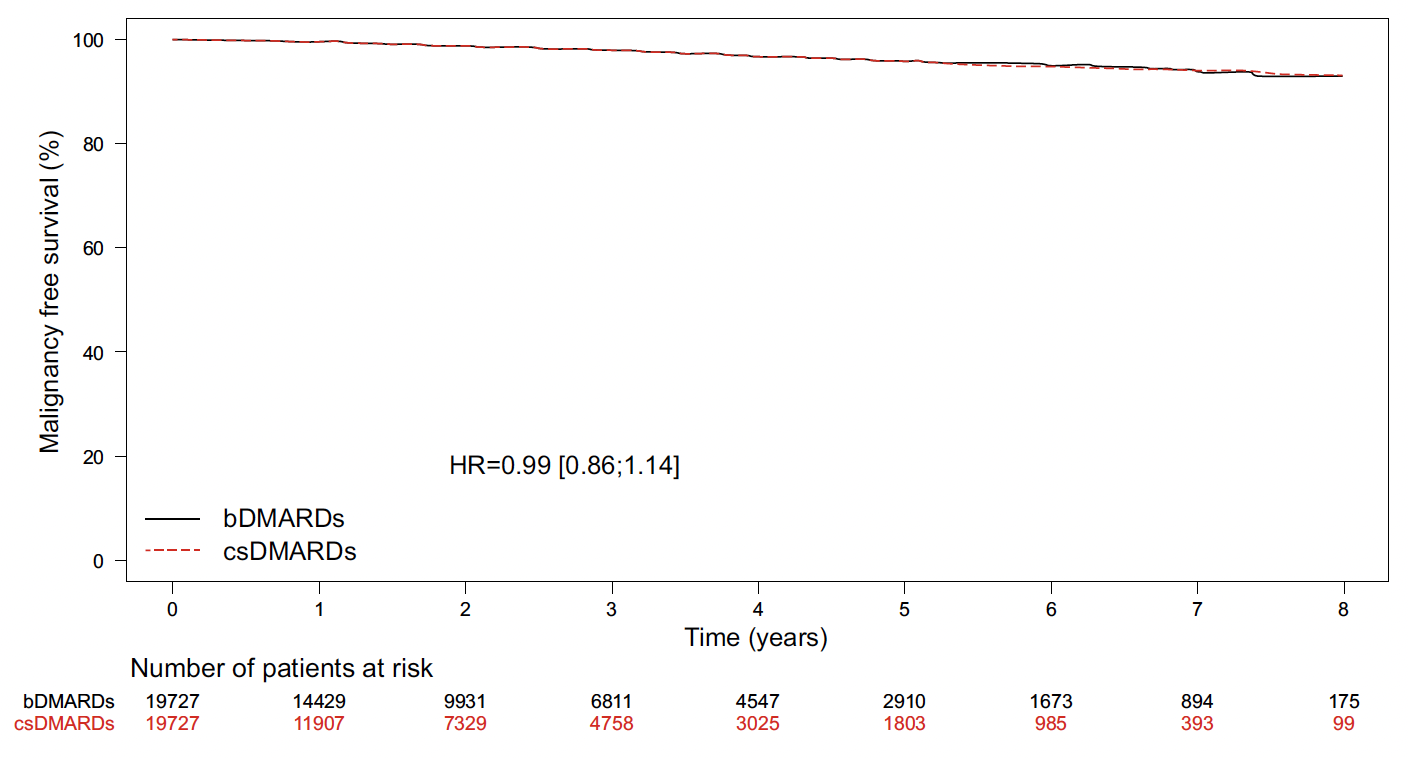
Figure 3 – Risque de cancer chez les patients atteints de PR initiant une biothérapie par rapport aux patients sous csDMARDs (16).
Risque par type de cancer
En particulier, dans plusieurs études, les risques de cancer du poumon (14, 17), de lymphome (7, 14) ou de cancer du sein (14, 17) n’étaient pas associés aux anti-TNF.
Cependant, il est possible que le risque de tumeurs cutanées non mélanomes soit associé aux anti-TNF, alors que ceci ne semble pas être le cas pour le mélanome (18). De même, bien qu’il n’existe que peu d’études à ce sujet, le risque de cancer du col pourrait être associé aux anti-TNF (19). Toutefois, il est important de noter que l’augmentation du risque de ces cancers ne serait pas le propre des anti-TNF, ce risque ayant été bien mis en évidence pour d’autres classes d’immunosuppresseurs et notamment les anti-rejets.
L’abatacept
L’abatacept, de par son mécanisme d’action strictement opposé à celui des immunothérapies anti-cancéreuses modernes, suscite également des inquiétudes quant à son potentiel oncogénique, cependant les études sont peu nombreuses à ce jour.
Deux études retrouvaient une augmentation du risque de cancer global de l’ordre de 9 à 16 % par rapport aux autres biothérapies (20, 21). Cette augmentation du risque de cancer est probablement médiée par l’augmentation du risque de cancer cutané, mélanome et non mélanome, ainsi qu’un signal possible sur les cancers des voies urinaires.
Les inhibiteurs de JAK
L’augmentation du risque de cancer lié aux inhibiteurs de JAK, et notamment le tofacitinib, est la seule démontrée par une étude interventionnelle dédiée (2) avec un hazard ratio de 1,47 dans le groupe tofacitinib par rapport au groupe anti-TNF. Les cancers impliqués étaient pour la plupart des cancers du poumon ainsi que des cancers de la prostate. Cependant, il faut noter la limite de cette étude compte tenu de la rareté des événements (164 événements chez 4 362 patients). Paradoxalement, les études observationnelles réalisées jusqu’à présent n’ont pas permis de confirmer ces résultats, possiblement limitées par l’utilisation courante encore récente des inhibiteurs de JAK dans la PR. En effet, le risque de cancer était augmenté à partir de 2 ans d’exposition dans ORAL Surveillance, alors que les études observationnelles ont souvent un suivi plus court pour le moment. En outre, la plupart des études observationnelles ont étudié le baricitinib et non le tofacitinib. Des études à ce sujet sont encore attendues.
Le tocilizumab et le rituximab
Concernant le tocilizumab et le rituximab, il n’y a à ce jour pas de franc signal d’association au risque de cancer, sans que nous puissions déterminer s’il s’agit bien d’une absence de risque réel ou simplement lié au manque d’études de grande envergure à leur sujet. En effet, il est à noter que, dans notre étude évaluant le risque de cancer par rapport à la population générale, la biothérapie sous laquelle le risque de cancer était le plus élevé était le rituximab et notamment le risque d’hémopathies (9). Il s’agit possiblement de biais d’indication, mais des études de confirmation à ce sujet sont nécessaires.
Les auteurs déclarent avoir des liens d’intérêt avec BMS, Boheringher, Novartis, GSK, Janssen, Amgen.
Bibliographie
1. Beydon M, McCoy S, Nguyen Y et al. Epidemiology of Sjögren syndrome. Nat Rev Rheumatol 2024 ; 20 : 158‑69.
2. Ytterberg SR, Bhatt DL, Mikuls TR et al. Cardiovascular and Cancer risk with tofacitinib in rheumatoid arthritis. N Engl J Med 2022 ; 386 : 316‑26.
3. Wolfe F, Michaud K. Biologic treatment of rheumatoid arthritis and the risk of malignancy: analyses from a large US observational study. Arthritis Rheum 2007 ; 56 : 2886‑95.
4. Dreyer L, Mellemkjær L, Andersen AR et al. Incidences of overall and site specific cancers in TNFα inhibitor treated patients with rheumatoid arthritis and other arthritides – a follow-up study from the DANBIO Registry. Ann Rheum Dis 2013 ; 72 : 79‑82.
5. Mercer LK, Davies R, Galloway JB et al. Risk of cancer in patients receiving non-biologic disease-modifying therapy for rheumatoid arthritis compared with the UK general population. Rheumatology 2013 ; 52 : 91‑8.
6. Raaschou P, Simard JF, Holmqvist M et al. Rheumatoid arthritis, anti-tumour necrosis factor therapy, and risk of malignant melanoma: nationwide population based prospective cohort study from Sweden. BMJ 2013 ; 346 : f1939.
7. Wadström H, Frisell T, Askling J et al. Malignant neoplasms in patients with rheumatoid arthritis treated with tumor necrosis factor inhibitors, tocilizumab, abatacept, or rituximab in clinical practice: a nationwide cohort study from Sweden. JAMA Inter Med 2017 ; 177 : 1605‑12.
8. Wadström H, Pettersson A, Smedby KE, Askling J. Risk of breast cancer before and after rheumatoid arthritis, and the impact of hormonal factors. Ann Rheum Dis 2020 ; 79 : 581‑6.
9. Beydon M, Pinto S, De Rycke Y et al. Risk of cancer for patients with rheumatoid arthritis versus general population: a national claims database cohort study. Lancet Reg Health Eur 2023 ; 35 : 100768.
10. Hellgren K, Baecklund E, Backlin C et al Rheumatoid arthritis and risk of malignant lymphoma: is the risk still increased? Arthritis Rheumatol 2017 ; 69 : 700‑8.
11. Baecklund E, Iliadou A, Askling J et al. Association of chronic inflammation, not its treatment, with increased lymphoma risk in rheumatoid arthritis. Arthritis Rheum 2006 ; 54 : 692‑701.
12. Hellgren K, Di Giuseppe D, Smedby KE et al. Lymphoma risks in patients with rheumatoid arthritis treated with biological drugs-a Swedish cohort study of risks by time, drug and lymphoma subtype. Rheumatology 2021 ; 60 : 809‑19.
13. Bongartz T, Sutton AJ, Sweeting MJ et al. Anti-TNF antibody therapy in rheumatoid arthritis and the risk of serious infections and malignanciessystematic review and meta-analysis of rare harmful effects in randomized controlled trials. JAMA 2006 ; 295 : 2275‑85.
14. Huss V, Bower H, Wadström H et al. Short- and longer-term cancer risks with biologic and targeted synthetic disease-modifying antirheumatic drugs as used against rheumatoid arthritis in clinical practice. Rheumatology 2022 ; 61 : 1810‑8.
15. Solomon DH, Kremer JM, Fisher M et al. Comparative cancer risk associated with methotrexate, other non-biologic and biologic disease-modifying anti-rheumatic drugs. Semin Arthritis Rheum 2014 ; 43 : 489‑97.
16. Seror R, Lafourcade A, Rycke YD et al. Risk of malignancy in rheumatoid arthritis patients initiating biologics: an historical propensity score matched cohort study within the French nationwide healthcare database. RMD Open 2022 ; 8 : e002139.
17. Mercer LK, Lunt M, Low ALS et al. Risk of solid cancer in patients exposed to anti-tumour necrosis factor therapy: results from the British Society for Rheumatology Biologics Register for Rheumatoid Arthritis. Ann Rheum Dis 2015 ; 74 : 1087‑93.
18. Esse S, Mason KJ, Green AC, Warren RB. Melanoma risk in patients treated with biologic therapy for common inflammatory diseases: a systematic review and meta-analysis. JAMA Dermatol 2020 ; 156 : 787‑94.
19. Wadström H, Frisell T, Sparén P et al. Do RA or TNF inhibitors increase the risk of cervical neoplasia or of recurrence of previous neoplasia? A nationwide study from Sweden. Ann Rheum Dis 2016 ; 75 : 1272‑8.
20. Simon TA, Boers M, Hochberg M et al. Comparative risk of malignancies and infections in patients with rheumatoid arthritis initiating abatacept versus other biologics: a multi-database real-world study. Arthritis Res Ther 2019 ; 21 : 228.
21. Montastruc F, Renoux C, Dell’Aniello S et al. Abatacept initiation in rheumatoid arthritis and the risk of cancer: a population-based comparative cohort study. Rheumatology 2019 ; 58 : 683‑91.




