En 2024, la Société française de rhumatologie (SFR) a actualisé ses recommandations pour le diagnostic et la gestion de la polyarthrite rhumatoïde (PR), introduisant des directives spécifiques pour les populations à risque de développer une PR et les atteintes pulmonaires associées (PR-ILD). Ces nouvelles orientations visent à optimiser la qualité des soins grâce à une décision médicale partagée et une gestion globale.
Résumé
La Société française de rhumatologie (SFR) a actualisé la version de 2018 des recommandations de la prise en charge de la polyarthrite rhumatoïde (PR) (1). Fruits d’une collaboration entre experts en rhumatologie et représentants de patients, ces recommandations s’appuient sur la version de 2023 des recommandations européennes de l’Eular et des revues systémiques de la littérature. Deux nouveaux sujets sont abordés : les personnes à risque de développer une PR et les atteintes pulmonaires interstitielles (PR-ILD). Les principes généraux soulignent l’importance de la décision partagée et de la gestion globale des patients. Dix-neuf recommandations détaillent le diagnostic, les traitements et les stratégies de surveillance.
Abstract
SFR 2024 recommendations on rheumatoid arthritis
The French Society of Rheumatology (SFR) published updated 2024 recommendations for the management of rheumatoid arthritis (RA). This collaborative effort by rheumatology experts and patient representatives incorporates recent advancements, including the 2023 EULAR guidelines. New topics were addressed including people at risk of RA development and RA-associated interstitial lung disease (RA-ILD). The general principles emphasize shared decision-making and comprehensive patient management. Nineteen recommendations cover diagnostic criteria, treatments, and monitoring strategies.
Contexte et objectifs de la mise à jour
L’actualisation des recommandations de la Société française de rhumatologie (SFR) pour la polyarthrite rhumatoïde (PR) (1) intervient 6 ans après celles de 2018 (2), en raison de la pandémie de Covid-19 et d’une alerte de l’EMA sur la sécurité de certains traitements ciblés (JAKi). Cette mise à jour décalée (actualisation tous les 3 à 5 ans habituellement) a permis d’intégrer les conclusions du Comité de pharmacovigilance de l’EMA (PRAC) (3) dans cette nouvelle version. S’appuyant sur les recommandations Eular (European Alliance of Associations for Rheumatology), incluant les recommandations 2016 et 2023 sur la PR et celles de 2016 sur les arthrites débutantes (4, 5), cette édition aborde deux nouveaux domaines :
• les personnes à risque de développer une PR (appelées pré-PR)
• et la gestion des atteintes pulmonaires associées à la PR (PR-ILD).
Principes généraux des recommandations
Les recommandations 2024 reposent sur quatre principes directeurs :
• décision partagée : la gestion de la PR et de la pré-PR doit s’appuyer sur une collaboration étroite entre le patient et le rhumatologue, reposant sur l’information et l’éducation du patient ;
• rôle du rhumatologue et du généraliste : le rhumatologue est le spécialiste clé, mais le médecin généraliste joue un rôle crucial dans le dépistage initial et le suivi ;
• prise en charge globale : la gestion de la PR nécessite une approche intégrée qui combine traitements médicamenteux et non médicamenteux ;
• optimisation des coûts : une attention particulière est accordée aux coûts liés à la PR pour garantir une prise en charge rationnelle et durable. Dans cette perspective, il est essentiel de privilégier l’usage des biosimilaires, dont l’efficacité et la sécurité sont établies, ainsi que de considérer des stratégies de décroissance thérapeutique progressive en cas de rémission prolongée.
Diagnostic de la polyarthrite rhumatoïde
Le diagnostic de PR nécessite la présence d’au moins une arthrite clinique. Les auteurs insistent sur l’importance de l’arthrite clinique, qui ne peut pas être remplacée par une arthrite infraclinique (échographique ou IRM).
À retenir
• Diagnostic de PR = au moins une arthrite clinique.
Un traitement de fond doit être débuté dès que le diagnostic de PR est posé ou en présence de facteurs de risque d’arthrite persistante (atteinte polyarticulaire, syndrome inflammatoire biologique marqué, FR/ACPA positifs, atteinte radiographique) (Fig. 1).
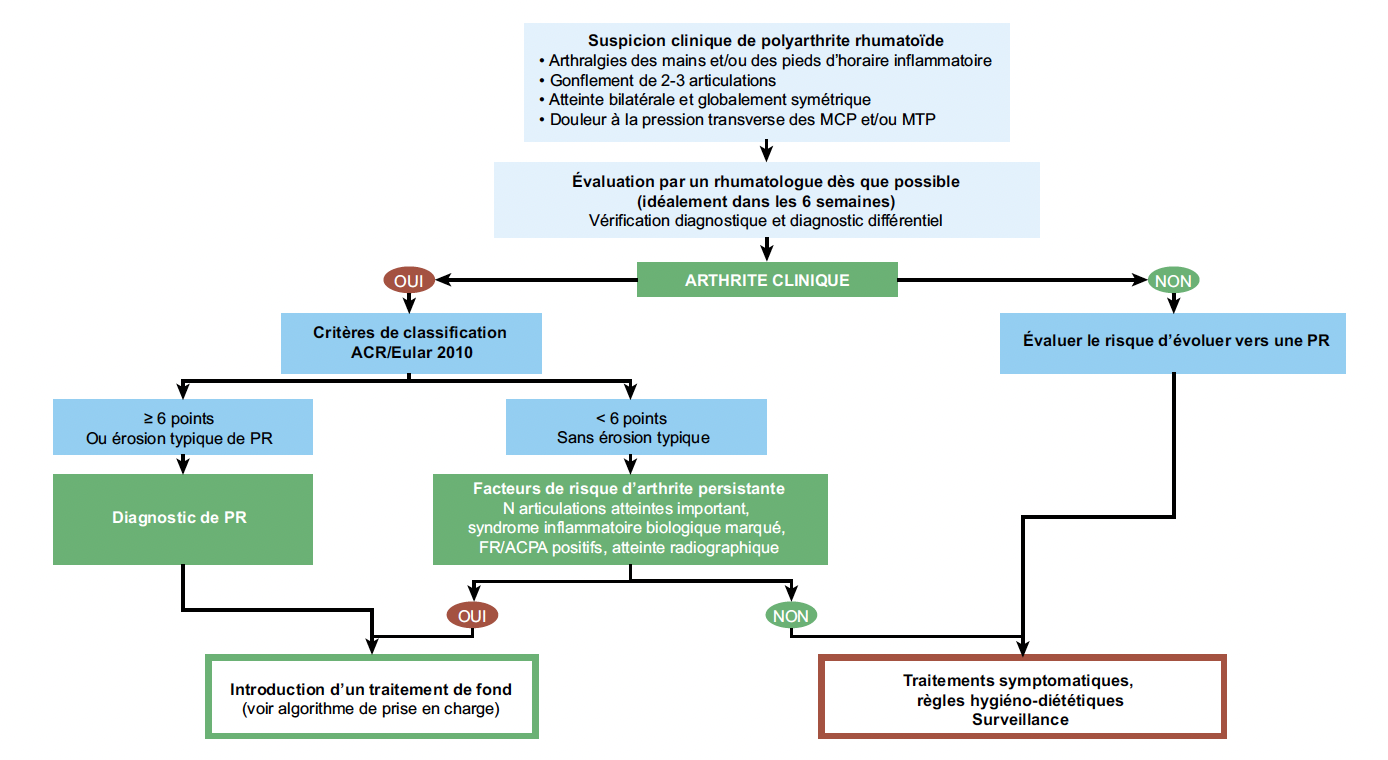
Figure 1 – Algorithme diagnostique de la polyarthrite rhumatoïde (1).
Patients à risque de développer une PR
Évaluation du risque
En cas de suspicion de PR et d’absence d’arthrite clinique, l’évaluation du risque d’évoluer vers une PR repose sur des critères cliniques, immunologiques et d’imagerie (6-8).
La pré-PR désigne un état caractérisé par la présence de facteurs de risque cliniques, biologiques et/ou environnementaux (Encadré 1) qui augmentent la probabilité de développer une PR, sans qu’une arthrite clinique soit encore apparente.

L’intérêt des anticorps anti-protéines carbamylées a été évoqué, mais ils n’ont pas été retenus en raison de leur inaccessibilité dans la pratique courante. De plus, les données de la littérature ne permettent pas de conclure à l’intérêt de suivre dans le temps la variation des taux des auto-anticorps spécifiques de PR.
Prise en charge
En cas de pré-PR, l’instauration d’un traitement de fond visant à prévenir l’apparition de la PR n’est pas recommandée. En effet, les glucocorticoïdes, l’hydroxychloroquine, le méthotrexate et les statines n’ont montré aucun effet sur le risque de progression vers une PR. Quant au rituximab et à l’abatacept, ils ont exercé un effet uniquement suspensif durant la période de traitement, retardant l’apparition de la PR sans réellement la prévenir (9).
La prise en charge repose donc sur des traitements symptomatiques, des mesures hygiéno-diététiques et une surveillance adaptée. Cette surveillance, reposant principalement sur la clinique, est recommandée sur une période de 1 à 3 ans, correspondant à la phase où le risque de progression vers une PR est le plus élevé. Il est essentiel d’apprendre aux patients à identifier les signes nécessitant une consultation rapide, notamment l’apparition de gonflements articulaires.
À retenir
• Pré-PR : pas de traitement de fond, uniquement traitement symptomatique.
La stratégie thérapeutique en 2024 (Fig. 2)
Les recommandations précisent les objectifs du traitement, qui doivent viser la rémission clinique ou, à défaut, une faible activité de la maladie. Un suivi rapproché par le rhumatologue (tous les 1 à 3 mois) est nécessaire tant que la maladie est active. S’il n’y a pas d’amélioration dans les 3 mois suivant le début du traitement ou si l’objectif thérapeutique n’a pas été atteint à 6 mois, le traitement doit être ajusté.
Le choix et l’adaptation thérapeutiques doivent prendre en compte d’autres facteurs que la mesure de l’activité de la maladie, comme la progression structurale, les atteintes extra-articulaires, les maladies associées, la tolérance et l’adhésion aux traitements, ainsi que l’avis et le ressenti du patient.
À retenir
• Suivi rapproché (tous les 1 à 3 mois) tant que PR active.
• Objectif de rémission ou à défaut activité faible.
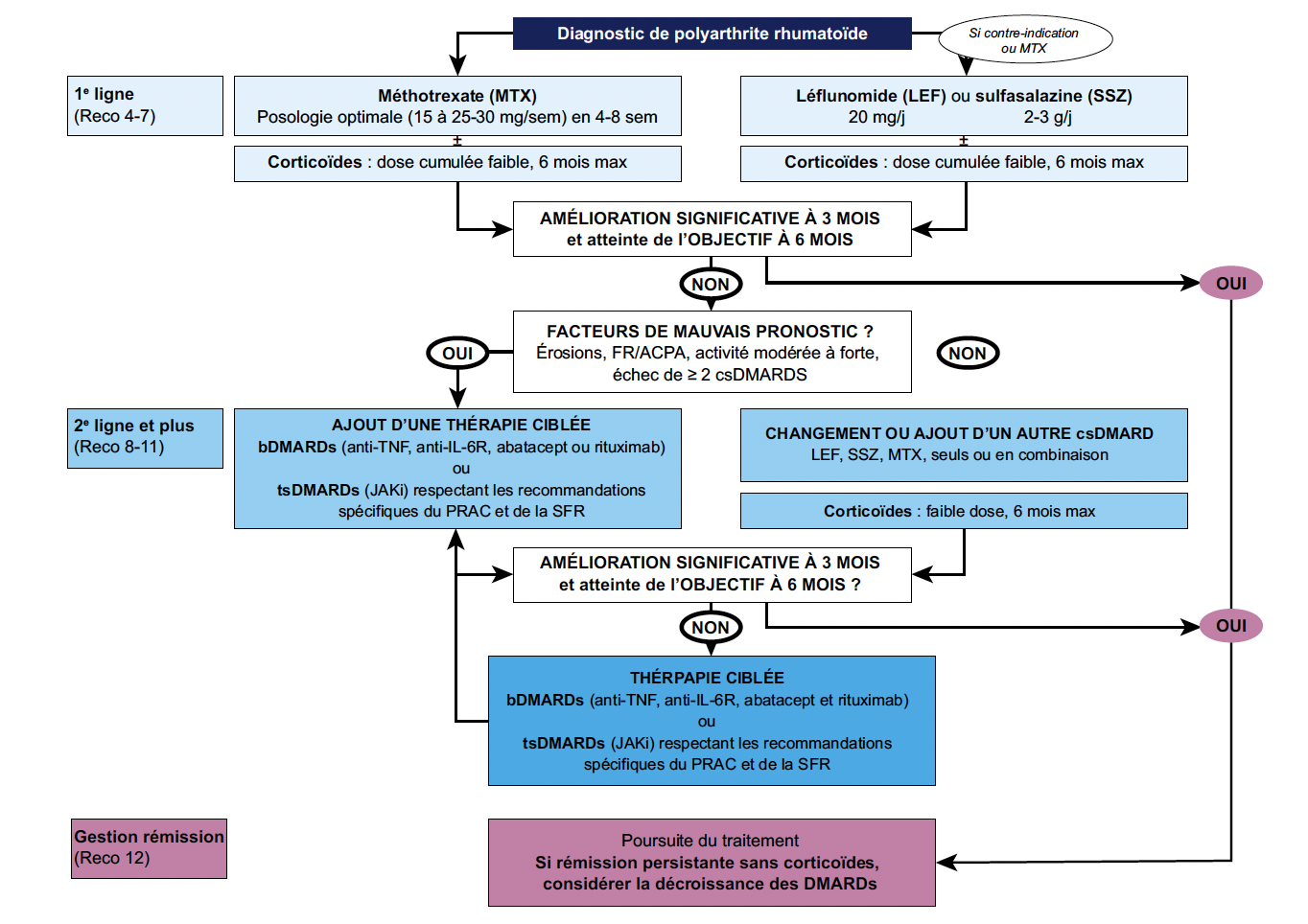
Figure 2 – Algorithme de la stratégie thérapeutique de la polyarthrite rhumatoïde en 2024 (1).
1re ligne : traitement par méthotrexate et autres csDMARDs
Le méthotrexate
Le méthotrexate (MTX) est toujours positionné comme le traitement de première intention avec un dosage initial de 15 mg/semaine, pouvant être optimisé jusqu’à 25 à 30 mg/semaine entre 1 et 3 mois en fonction du poids du patient, de l’efficacité et de la tolérance.
Les recommandations n’établissent pas de préférence pour une voie d’administration initiale (orale ou sous-cutanée) du méthotrexate, le choix devant être fait dans le cadre d’une discussion partagée entre le rhumatologue et le patient.
Les autres recommandations restent inchangées : la prise de MTX doit être accompagnée d’une supplémentation en acide folique à raison d’au moins 10 mg/semaine. Le MTX, en première ligne de traitement de la PR, doit être utilisé en monothérapie.
Contre-indication ou intolérance au méthotrexate
Chez les patients naïfs de traitement de fond, le léflunomide ou la sulfasalazine constituent des alternatives thérapeutiques en cas de contre-indication au MTX ou d’intolérance précoce. En raison de sa faible efficacité clinique et de l’absence d’effets structuraux, l’hydroxychloroquine n’est pas recommandée en première ligne (4, 5).
Pour les patients insuffisamment répondeurs ou intolérants au méthotrexate (ou à un autre csDMARD – Disease-modifying antirheumatic drugs – de première ligne) et en l’absence de facteurs de mauvais pronostic, il est possible de proposer une rotation ou une association de traitements de fond synthétiques conventionnels.
À retenir
• Posologie initiale du métho-trexate d’au moins 15 mg/semaine.
Utilisation d’une corticothérapie comme traitement d’appoint
Une corticothérapie orale ou injectable peut être utilisée en traitement d’appoint lors de l’initiation d’un DMARD afin de contrôler l’inflammation. Cependant, elle doit être prescrite à la dose la plus faible possible et pour une durée limitée, idéalement de 3 à 6 mois maximum.
À retenir
• Si une corticothérapie est utilisée, prescrire la dose minimale efficace sur une durée limitée.
Utilisation d’une thérapeutique ciblée (Fig. 2)
En cas de réponse insuffisante au MTX (ou autre csDMARD de 1re ligne) et en présence de facteurs de mauvais pronostic, l’addition d’une thérapeutique ciblée biologique ou synthétique doit être proposée.
Cas des inhibiteurs de JAK
Les inhibiteurs de JAK (JAKi) sont associés à des risques spécifiques qui nécessitent une attention particulière, notamment un risque accru d’événements cardiovasculaires majeurs et de cancers. Ces préoccupations ont conduit la SFR à établir un consensus rigoureux sur leur utilisation (Fig. 2) (3). Ce consensus recommande une évaluation approfondie du profil de risque des patients avant leur prescription, avec une préférence pour d’autres options thérapeutiques (anti-TNF ou anti-IL-6R) chez les patients présentant des antécédents cardiovasculaires.
Bien que des études suggèrent que certains JAKi pourraient être plus efficaces que l’adalimumab ou l’abatacept dans certains contextes, le groupe d’experts souligne qu’aucun traitement ciblé biologique (bDMARD) n’a démontré de supériorité globale en cas d’échec des DMARDs conventionnels (csDMARDs). Ainsi, la balance bénéfice/risque des JAKi ne justifie pas leur utilisation préférentielle, et leur prescription doit tenir compte du profil de risque individuel du patient.
Bien que la SFR considère les JAKi comme une option de 2e ligne, au même titre que les bDMARD, en fonction du profil du patient, la HAS recommande de réserver leur utilisation à la 3e ligne, après un échec ou une intolérance à un anti-TNF (10).
À retenir
• Respect des recommandations du PRAC et de la SFR pour la prescription des JAKi.
Choix du traitement
Le choix et la prescription du traitement se fondent sur l’activité de la PR et le profil du patient (Tab. 1).
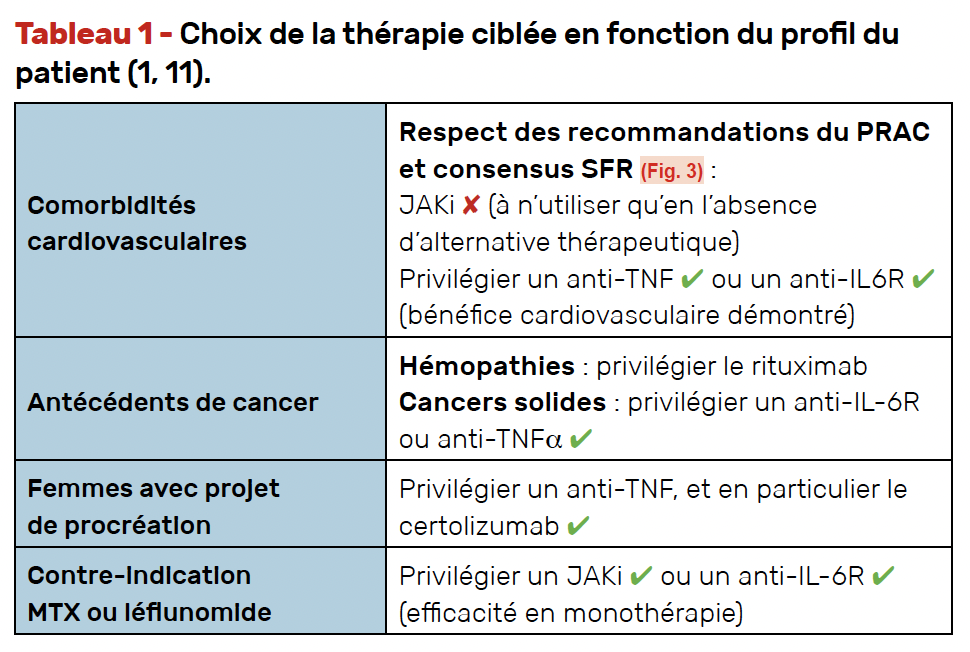
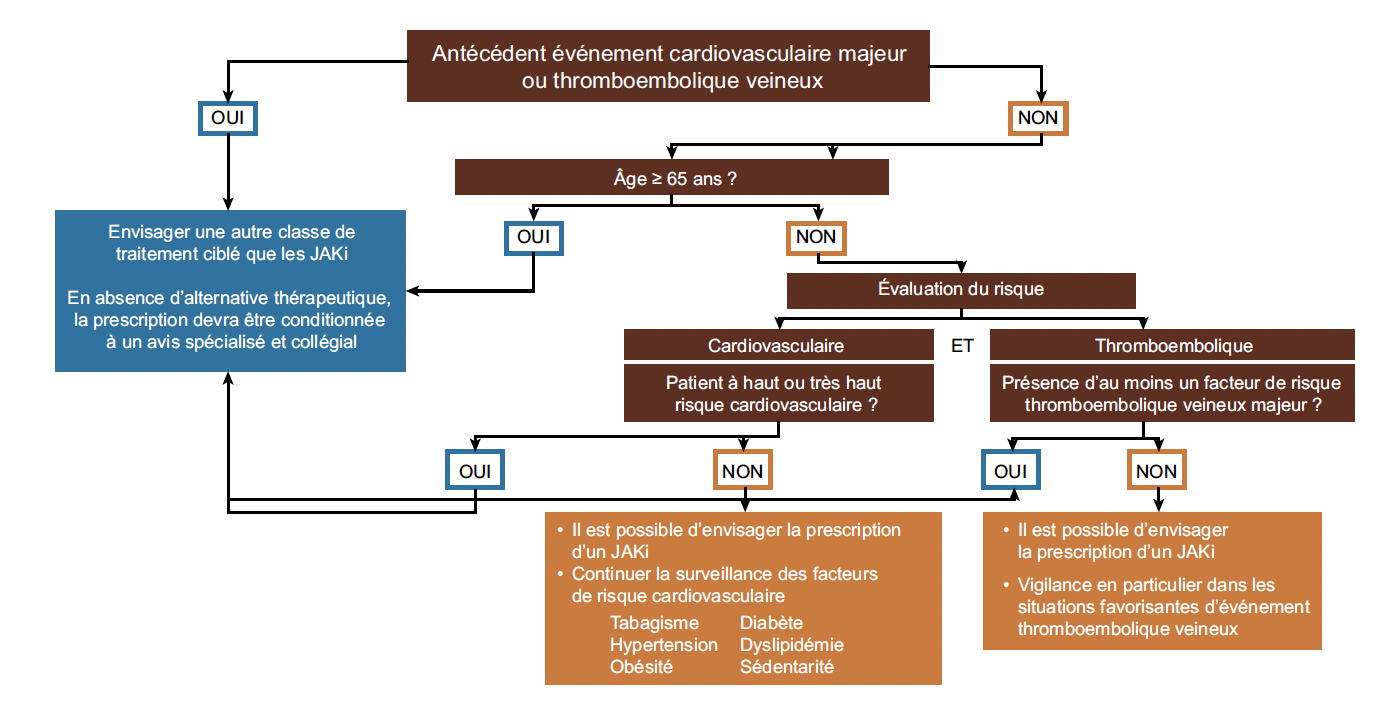
Figure 3 – Évaluation du risque cardiovasculaire selon le travail du groupe de consensus de la SFR et du PRAC (3).
• Les traitements ciblés doivent être utilisés de préférence en association avec le MTX (ou léflunomide si contre-indication).
• En cas de contre-indication, les anti-IL-6R et les JAKi sont des alternatives efficaces, y compris en monothérapie (efficacité similaire en monothérapie ou combinaison avec csDMARDs).
• En cas d’échec primaire, les nouvelles recommandations ne prévoient plus systématiquement un changement de classe. Toutefois, si deux DMARDs ciblés bloquant la même voie s’avèrent inefficaces, il est recommandé de changer de voie thérapeutique.
Décroissance progressive des traitements de fond
En cas de rémission persistante (au moins 6 mois) sans glucocorticoïdes, une réduction progressive des traitements de fond (qu’ils soient synthétiques conventionnels ou ciblés) doit être envisagée. De nombreuses études ont montré qu’il existe un risque de surtraitement chez les PR en rémission prolongée. En effet, la dose nécessaire pour induire la rémission lorsque la maladie est active est probablement plus élevée que celle requise pour maintenir la rémission. L’enjeu principal réside dans l’identification de la dose minimale efficace pour maintenir la rémission.
En pratique
Dans la version de 2017, la décroissance était recommandée en deux temps, avec décroissance de la thérapie ciblée puis du csDMARD. Cependant, des données ont montré qu’il y a plus de rechutes lors de la décroissance des thérapies ciblées que lors de la décroissance des csDMARDs. Ainsi, le groupe d’experts a estimé que le choix de la molécule à diminuer peut être laissé au rhumatologue, dans le cadre d’une décision partagée avec le patient. La réduction thérapeutique peut s’effectuer soit par une diminution progressive de la posologie (si plusieurs dosages sont disponibles), soit par un espacement des prises. Attention, cet objectif de prévention d’un surtraitement n’est pas équivalent à un objectif d’arrêt (“vacances thérapeutiques”) du fait d’un risque important de rechute, en cas de décroissance au-delà de la dose minimale efficace.
À retenir
• Choix du traitement à réduire en priorité : thérapie ciblée ou csDMARD, à décider avec le patient.
• Méthodes de réduction : diminution progressive de la dose ou espacement des prises.
Gestion des comorbidités et des risques associés
La prise en charge de la PR doit intégrer un suivi régulier des comorbidités, notamment le risque cardiovasculaire, l’ostéoporose, les infections et la dépression. Un dépistage des facteurs de risque, tels que le tabagisme, l’obésité et la sédentarité, est essentiel, accompagné de conseils pour adopter un mode de vie sain, incluant une alimentation équilibrée selon les recommandations spécifiques de la SFR depuis 2018.
La fréquence des évaluations doit être adaptée au niveau de risque individuel et aux besoins du patient. Pour le risque cardiovasculaire, une évaluation au moins tous les 5 ans est préconisée par l’Eular et la SFR. Une attention particulière est requise pour les patients sous JAKi en raison des risques accrus de complications cardiovasculaires et de néoplasies identifiés dans les dernières études. La SFR insiste sur l’importance d’un suivi personnalisé et rigoureux pour ces traitements.
À retenir
• Suivi régulier des comorbidités
• Dépistage des facteurs de risque
• Évaluation cardiovasculaire tous les 5 ans
• Surveillance cardiovasculaire et néoplasique sous JAKi
Dépistage et prise en charge de la PR-PID
Dépistage
Les atteintes respiratoires doivent être systématiquement évaluées chez les patients atteints de PR, tant au moment du diagnostic qu’au cours du suivi. La présence de symptômes ou signes physiques (toux chronique, dyspnée, anomalies à l’auscultation, hippocratisme digital, etc.) nécessite la réalisation d’un scanner thoracique haute résolution, examen de référence pour diagnostiquer une pneumopathie interstitielle diffuse (PID) (12). En l’absence de signes ou symptômes respiratoires, un dépistage systématique par scanner n’est pas recommandé.
Prise en charge
La prise en charge des patients atteints de PR-PID doit être coordonnée entre rhumatologues et pneumologues, avec un suivi incluant une évaluation régulière des symptômes respiratoires à chaque consultation et des explorations fonctionnelles respiratoires (EFR) tous les 6 à 12 mois, notamment la mesure de la DLCO. Les patients doivent également être informés des signes évocateurs d’une aggravation pulmonaire (Encadré 2). Environ 50 % des cas de PR-PID présentent une évolution stable, ne nécessitant pas de traitement spécifique (13).

Concernant les traitements, chez un patient PR avec une PID, l’initiation ou la poursuite d’un traitement par MTX est possible. En cas d’initiation d’un traitement ciblé chez un patient atteint de PR-PID, il est préférable d’utiliser l’abatacept ou le rituximab. L’indication d’un anti-fibrosant ou d’un immunosuppresseur au cours de la PR-PID reste posée au cas par cas après discussion multidisciplinaire avec un pneumologue expert.
À retenir
Surveillance PR-PID
• Chaque consultation -> évaluation symptômes respiratoires
• Tous les 3 à 6 mois -> EFR (avec mesure DLCO)
• Si aggravation respiratoire -> TDM thoracique
Traitement de fond PR-PID
• Méthotrexate (initiation et poursuite)
• Si introduction traitement ciblé : privilégier rituximab ou abatacept

Jérôme Avouac déclare avoit des liens d’intérêt avec Galapagos, Alfasigma, Lilly, Pfizer, Abbvie, Bristol-Myers Squibb, Nordic Pharma, Medac, Novartis, Biogen, Fresenius Kabi, Celltrion, Janssen et MSD.
Bibliographie
1. Fautrel B, Kedra J, Rempenault C et al. 2024 update of the recommendations of the French Society of Rheumatology for the diagnosis and management of patients with rheumatoid arthritis. Joint Bone Spine 2024 ; 91 : 105790.
2. Daien C, Hua C, Gaujoux-Viala C et al. Update of French society for rheumatology recommendations for managing rheumatoid arthritis. Joint Bone Spine 2019 ; 86 : 135‑50.
3. Avouac J, Fogel O, Hecquet S et al. Recommendations for assessing the risk of cardiovascular disease and venous thromboembolism before the initiation of targeted therapies for chronic inflammatory rheumatic diseases. Joint Bone Spine 2023 ; 90 : 105592.
4. Combe B, Landewe R, Daien CI et al. 2016 update of the EULAR recommendations for the management of early arthritis. Ann Rheum Dis 2017 ; 76 : 948‑59.
5. Smolen JS, Landewé RBM, Bergstra SA et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2022 update. Ann Rheum Dis 2023 ; 82 : 3‑18.
6. Tang B, Liu Q, Ilar A et al. Occupational inhalable agents constitute major risk factors for rheumatoid arthritis, particularly in the context of genetic predisposition and smoking. Ann Rheum Dis 2023 ; 82 : 316‑23.
7. Sokolove J, Bromberg R, Deane KD et al. Autoantibody epitope spreading in the pre-clinical phase predicts progression to rheumatoid arthritis. PLoS One 2012 ; 7 : e35296.
8. Samborska-Mazur J, Sikorska D, Wyganowska-Świątkowska M. The relationship between periodontal status and rheumatoid arthritis – systematic review. Reumatologia 2020 ; 58 : 236‑42.
9. Krijbolder DI, Verstappen M, Dijk BT van et al. Intervention with methotrexate in patients with arthralgia at risk of rheumatoid arthritis to reduce the development of persistent arthritis and its disease burden (TREAT EARLIER): a randomised, double-blind, placebo-controlled, proof-of-concept trial. Lancet 2022 ; 400 : 283‑94.
10. Haute Autorité de santé (HAS). Réévaluation des anti-JAK dans la polyarthrite rhumatoïde. Disponible sur : www.has-sante.fr/jcms/p_3482864/fr/xeljanz-tofacitinib-polyarthrite-rhumatoide-pr.
11. Sebbag E, Lauper K, Collada JM et al. Eular points to consider on the initiation of targeted therapies in patients with inflammatory arthritides and a history of cancer. Ann Rheum Dis 2023 ; 82 : 29.
12. Raghu G, Remy-Jardin M, Myers JL et al. Diagnosis of idiopathic pulmonary fibrosis. an official ATS/ERS/JRS/ALAT clinical practice guideline. Am J Respir Crit Care Med 2018 ; 198 : e44‑68.
13. Koduri G, Solomon JJ. Identification, monitoring, and management of rheumatoid arthritis–associated interstitial lung disease. Arthritis Rheumatol 2023 ; 75 : 2067‑77.




