Les symptômes du syndrome sec sont nombreux, peuvent être invalidants et altérer la qualité de vie des patients. Les étiologies sont multiples. La maladie de Sjögren est la maladie systémique la plus pourvoyeuse de syndrome sec. Le traitement est exclusivement symptomatique.
Résumé
Les manifestations du syndrome sec sont nombreuses et peuvent altérer la qualité de vie des patients. La sécheresse peut être confirmée par des tests simples objectivant le déficit en larmes ou en salive. Les causes sont multiples : vieillissement, iatrogénie, toxiques, syndrome asthénie polyalgies sécheresse et certaines maladies systémiques. La maladie de Sjögren (MS) est la maladie auto-immune systémique la plus pourvoyeuse de syndrome sec. Elle doit notamment être évoquée en cas de gonflement des glandes parotides ou sous-maxillaires, d’arthralgies inflammatoires ou de tout autre symptôme évoquant une atteinte systémique en lien avec la maladie. Le diagnostic est confirmé par la positivité des anticorps anti-SS-A (Ro) dans le sang et/ou la présence d’un infiltrat lympho-plasmocytaire de grade 3 ou 4 de Chisholm sur la biopsie de glandes salivaires accessoires. Aucun traitement de fond immunosuppresseur ou immunomodulateur n’a montré son efficacité sur les manifestations du syndrome sec. Ils ne sont donc pas recommandés dans cette indication. Le traitement du syndrome sec est symptomatique. Le chlorhydrate de pilocarpine peut augmenter la production salivaire et réduire les anomalies de la surface oculaire en rapport avec la kérato-conjonctivite. Son utilisation est limitée par des effets secondaires fréquents. Les patients doivent bénéficier d’un suivi ophtalmologique et odontologique régulier afin de dépister d’éventuelles complications associées au syndrome sec. La sécheresse de la sphère génitale est fréquente et parfois très invalidante. Elle requiert une expertise gynécologique. Dans la MS, plusieurs essais de phase II ou III retrouvent des résultats encourageants sur la prise en charge de la sécheresse avec parfois une augmentation du débit salivaire.
Abstract
Management of sicca symptoms
The manifestations of sicca symptoms are numerous and have the capacity to affect patients’ quality of life. The diagnosis of dryness is made using simple tests that show a deficit in tears or saliva. The etiology of dry syndrome is multifactorial, with potential causative factors including ageing, iatrogenics, toxic substances, asthenia-polyalgia-dryness syndrome, and systemic diseases. Sjögren’s disease is the systemic autoimmune disease that most frequently causes sicca symptoms. A clinical suspicion should be raised if there is evidence of parotid gland or submandibular gland swelling, inflammatory arthralgias, or any other symptom that could be indicative of systemic disease. The diagnosis is confirmed by the positivity of anti-SS-A (Ro) antibodies in the blood and/or the presence of a Chisholm grade 3 or 4 lymphoplasmacytic infiltrate on biopsy of the accessory salivary glands. It is important to note that no immunosuppressive or immunomodulatory background treatment has been shown to be effective in the manifestations of sicca symptoms. Consequently, they are not recommended for. Treatment of sicca symptoms is symptomatic. Pilocarpine has been observed to increase saliva production and reduce ocular surface abnormalities associated with keratoconjunctivitis. However, its utilization is constrained by the occurrence of adverse effects. Patients should receive regular ophthalmological and odontological follow-up to detect any complications associated with sicca symptoms. Dryness in the genital area is common and can be very debilitating. It requires gynecological expertise. In Sjögren’s disease, several phase 2 or 3 trials have shown encouraging results in the treatment of dryness, sometimes with an increase in salivary flow.
Introduction
Le syndrome sec est un ensemble de symptômes résultant d’une diminution des sécrétions de diverses muqueuses. Les principaux organes atteints sont la bouche et les yeux, mais d’autres organes peuvent être touchés, notamment la sphère génitale et la peau. Ces symptômes de sécheresse apparaissent fréquemment de façon transitoire dans la population générale et, le plus souvent, ne sont pas le signe d’une maladie. Qui n’a pas ressenti une sensation de bouche sèche au moment d’une bouffée d’angoisse ou d’un stress important ? Qui n’a pas ressenti une sensation de brûlure oculaire après une journée passée devant un écran d’ordinateur ? Le caractère pathologique d’un syndrome sec tient à sa persistance dans le temps, et donc à son retentissement chez le patient.
Comment objectiver un syndrome sec ?
Il est possible de quantifier objectivement la diminution de sécrétion des larmes et de la salive par différents examens (Encadré 1). Ainsi, le syndrome sec est dit objectif s’il existe des anomalies oculaires ou buccales mesurables ; dans le cas contraire, on parle de syndrome sec subjectif.

Manifestations cliniques et conséquences du syndrome sec
Les manifestations du syndrome sec sont nombreuses et peuvent avoir des conséquences importantes dans la vie quotidienne des patients, notamment dans sa vie sociale.
• La sécheresse buccale peut se compliquer de caries ou d’aphtes. Le déficit salivaire va rendre difficiles la mastication et la formation du bol alimentaire. Il peut également altérer la phonation et rendre difficile une conversation longue.
• La sécheresse oculaire est liée à un déficit qualitatif ou quantitatif des larmes, et plus spécifiquement de la couche hydratante extrêmement fine qui couvre et protège la cornée. Cette diminution des larmes peut entraîner une kérato-conjonctivite sèche, et se compliquer parfois d’infections.
• La sécheresse de la peau peut provoquer des démangeaisons et des rougeurs, celle du nez, des irritations et des croûtes. En cas de syndrome sec, on observe fréquemment une toux sèche liée à la sécheresse de la trachée et des bronches.
• La sécheresse de la sphère génitale peut entraîner un déséquilibre de la flore vaginale, provoquant un prurit vulvaire, voire des infections locales, en particulier chez les femmes ménopausées.
Causes du syndrome sec
Elles sont variées. Il faut savoir évoquer des causes physiologiques (syndrome sec lié au vieillissement, syndrome sec vaginal et cutané après la ménopause), des facteurs locaux (comme le port de lentilles de contact pour le syndrome sec oculaire isolé), des causes iatrogènes/toxiques et également des maladies systémiques au premier rang desquelles la maladie de Sjögren (MS). Enfin, le syndrome sec peut être également une manifestation psychosomatique d’un syndrome anxiodépressif chronique.
Les causes iatrogéniques/toxiques
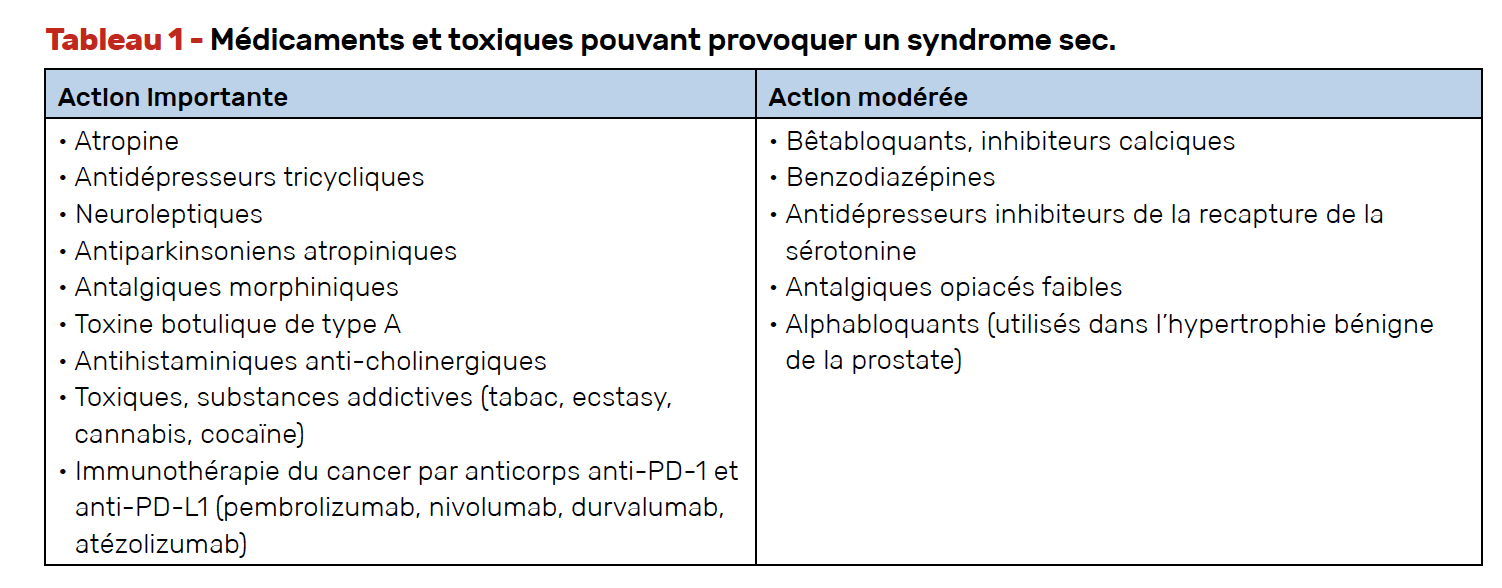
C’est l’une des principales causes de syndrome sec. La sécheresse est l’un des effets indésirables le plus commun de la prise médicamenteuse. Les médicaments et toxiques le plus souvent en cause sont indiqués dans le tableau 1. À noter des cas de syndrome sec parfois sévère induit par les inhibiteurs de point de contrôle immunitaire (1) utilisés largement dans le traitement des cancers. Il faut également rappeler que la radiothérapie cervico-faciale peut induire une sécheresse buccale séquellaire importante.
Les causes psychologiques
Le stress, l’anxiété et la dépression peuvent provoquer une sécheresse. Dans certains cas, le syndrome sec peut être une manifestation psychosomatique d’un syndrome anxiodépressif chronique. Ces syndromes secs d’origine psychogène peuvent en outre s’accompagner d’anomalies objectives. En effet, la sécrétion de larmes ou de salive est sous le contrôle de nerfs végétatifs dont le fonctionnement peut être modifié en cas de troubles psychiques.
Le syndrome sec s’associe alors souvent aux douleurs diffuses et à la fatigue chronique, faisant évoquer le diagnostic de fibromyalgie. Il a été proposé d’appeler cette association du syndrome sec à un syndrome fibromyalgique le « SAPS » : syndrome asthénie polyalgies sécheresse (2).
Les maladies systémiques
Le syndrome sec peut être un symptôme d’une maladie systémique bien individualisée. C’est le cas pour :
• le diabète décompensé,
• la sarcoïdose,
• l’amylose,
• la réaction du greffon contre l’hôte après allogreffe de moelle osseuse
• et la MS.
La maladie de Sjögren
La MS est une maladie systémique auto-immune classée dans les maladies rares. Sa prévalence est estimée entre 1/1 000 et 1/10 000. Elle touche dans 90 % des cas les femmes.
Manifestations cliniques
Elle est caractérisée par une infiltration lymphocytaire des glandes salivaires et lacrymales responsable d’un syndrome sec oculo-buccal, plus ou moins associé à diverses complications systémiques (3). Parmi les maladies systémiques, c’est la cause la plus fréquente de syndrome sec.
On distingue habituellement dans la MS :
• d’une part la triade symptomatique sécheresse/douleurs articulaires/fatigue, qui peut être évaluée par l’index ESSPRI (Eular Sjögren’s syndrome patient reported index) (4)
• et, d’autre part, les complications systémiques présentes dans 30 à 40 % des cas. La plus fréquente est l’existence de gonflements parotidiens ou sous-maxillaires.
Les douleurs articulaires peuvent s’accompagner de vrais épisodes de polyarthrite touchant préférentiellement les petites articulations. À la différence de la polyarthrite rhumatoïde (PR), il n’y a pas de complication structurale. On peut retrouver des signes cutanés, essentiellement de type purpura vasculaire, des atteintes pulmonaires interstitielles, des adénopathies, des atteintes neurologiques périphériques ou plus rarement centrales, des atteintes musculaires à type de myosite sont également possibles et des atteintes rénales, le plus souvent interstitielles.
La MS peut être primitive ou associée à une autre maladie auto-immune systémique comme la PR, le lupus érythémateux systémique, la sclérodermie ou les myopathies inflammatoires. Enfin, il existe un risque de lymphome (le plus souvent de la zone marginale), qui est environ 10 fois plus fréquent que dans la population générale.
La sévérité de l’atteinte systémique peut être appréciée en utilisant l’ESSDAI (Eular Sjögren’s syndrome disease activity index) (5).
Diagnostic
La triade symptomatique sécheresse/fatigue/douleurs articulaires est très fréquente dans la population générale. Les éléments suivants doivent faire rechercher une MS :
• épisodes de gonflement des glandes parotidiennes ou des sous-maxillaires ;
• arthralgies d’horaire inflammatoire ;
• sécheresse buccale et/ou oculaire invalidante, obligeant le patient à boire la nuit et souvent à mettre des gouttes lubrifiantes dans les yeux, sans facteurs locaux favorisants ou prise médicamenteuse ;
• symptômes faisant évoquer une atteinte systémique.
En 2016 ont été publiés les critères internationaux validés par l’ACR et l’Eular. Ces critères ne comportent plus les symptômes et ciblent des patients présentant des symptômes de sécheresse ou des signes systémiques évoquant la maladie (Encadré 2) (6). Ils exigent pour affirmer le diagnostic :
• soit la présence d’anticorps anti-SS-A (Ro) dans le sang,
• soit la présence d’un infiltrat lympho-plasmocytaire de grade 3 ou 4 de Chisholm sur la biopsie de glandes salivaires accessoires (BGSA).

En l’absence d’anticorps anti-SS-A, l’échographie des glandes salivaires est un outil non invasif pouvant permettre de sursoir à la réalisation d’une BGSA (7). En effet, sa normalité a une forte valeur prédictive négative dans cette situation (8). En cas de difficultés diagnostiques, les patients peuvent être adressés à des consultations multidisciplinaires dédiées.
Prise en charge du syndrome sec associé à une maladie de Sjögren
Les recommandations de prise en charge du syndrome sec associé à la MS sont résumées ici et ont été publiées en 2022 dans le PNDS sur la MS (9). Les mesures symptomatiques peuvent également être proposées aux patients souffrant d’un syndrome sec idiopathique ou dans le cadre d’un SAPS.
Aucun traitement de fond immunosuppresseur ou immunomodulateur n’ayant montré son efficacité sur les manifestations du syndrome sec, ils ne sont pas recommandés dans cette indication. Il faut rappeler que le traitement par hydroxychloroquine n’est pas efficace sur la triade symptomatique de la MS et n’a notamment pas d’effet sur le débit salivaire (10).
La sécheresse buccale
Il conviendra d’abord d’informer les patients sur les substances susceptibles d’aggraver la sécheresse buccale, notamment éviter la consommation de caféine, d’alcool, et de tabac. Il est également nécessaire de rechercher une prise médicamenteuse pouvant aggraver la symptomatologie (Tab. 1).
Alimentation et hydratation
L’alimentation devra limiter les apports acides et privilégier les plats en sauce. De plus, une hydratation tout au long de la journée est préconisée (1,5 l/jour).
L’approche thérapeutique de la sécheresse buccale doit être guidée en fonction de la persistance ou non d’une capacité à produire de la salive : celle-ci peut être évaluée par la mesure du flux salivaire. En l’absence de flux salivaire persistant, les traitements sécrétagogues se révèlent souvent inefficaces.
Le chlorhydrate de pilocarpine
La stimulation pharmacologique repose essentiellement sur les agonistes muscariniques ; nous disposons en France du chlorhydrate de pilocarpine. Une méta-analyse publiée en 2024 démontre son intérêt pour augmenter la production salivaire et réduire les anomalies de la surface oculaire en rapport avec la kérato-conjonctivite (11). Cependant, son usage reste limité par des effets secondaires fréquents, notamment une hypersudation, des troubles gastro-intestinaux et des sensations vertigineuses. Pour limiter ces problèmes de tolérance, il est recommandé d’introduire le traitement à dose progressivement croissante en débutant à 2 mg deux fois/jour jusqu’à une dose maximale de 15 à 20 mg/jour répartie en trois ou quatre prises. La pilocarpine peut également être efficace sur la sécheresse nasale, bronchique et vaginale. Elle est disponible sur le marché sous le nom de Salagen® à la dose de 5 mg/gélule, mais n’est pas remboursable. Cette formulation à dose relativement élevée est inadaptée pour permettre une bonne tolérance lors de l’initiation. Il est recommandé de faire fabriquer des gélules de chlorhydrate de pilocarpine à 2 et 4 mg sous forme de préparation magistrale qui permettent une introduction plus progressive des doses et une meilleure tolérance.
Les substituts salivaires
On peut également proposer des substituts salivaires. Ils sont disponibles sous forme de gel, sprays ou bains de bouche. Ils doivent avoir dans l’idéal une composition avec un pH neutre, contenir du fluor et généralement d’autres électrolytes pour imiter la composition de la salive naturelle. Leur efficacité reste très limitée dans les études, mais ils ont l’avantage de ne pas avoir d’effets secondaires.
Les stimulations de la sécrétion salivaire non pharmacologiques
L’utilisation de stimulants de la sécrétion salivaire non pharmacologiques peut également être utile. Les bonbons acides ou les chewing-gums sans sucre et les pastilles de xylitol peuvent améliorer le confort des patients. Les autres sécrétagogues de l’alimentation, tels que les jus de citron ou d’agrumes, sont en général mal tolérés et sont délétères pour la denture déjà fragilisée par la maladie.
Les auto-massages parotidiens et des glandes sous-maxillaires
Les auto-massages parotidiens et des glandes sous-maxillaires sont à conseiller aux patients, à la fois pour favoriser la salivation, mais également pour drainer la salive résiduelle souvent épaisse et diminuer les épisodes de gonflements parotidiens. Ils peuvent être réalisés deux ou trois fois par jour, notamment pendant les repas ou les situations nécessitant une augmentation de la salivation. Ils consistent en la réalisation de massages de l’arrière vers l’avant de la parotide pour faciliter l’excrétion de la salive dans la cavité buccale par le canal de Sténon. De la même manière, des massages de la glande sous-maxillaire de l’arrière vers l’avant peuvent aider à l’écoulement de la salive par le canal de Wharton. Vous retrouverez tous les conseils pratiques dans une vidéo de la Fai²r.
Prévention des conséquences possibles
Les patients devront être informés des conséquences possibles de la sécheresse buccale sur la sphère orale, à savoir le risque accru de :
• lésions carieuses,
• candidoses
• et altération des muqueuses et du parodonte.
Il est recommandé un suivi odontologique tous les 6 mois, qui pourra être adapté par le dentiste selon l’état buccal du patient. Il est à noter qu’il n’y a pas de restriction à la pose d’implants.
La fluoroprophylaxie est primordiale dans la prévention des lésions carieuses induite par l’hyposialie. Les apports en fluor devront être adaptés (dentifrice fluoré, gel fluoré, application de topique) en fonction de la gravité de celle-ci.
La sécheresse oculaire
Évaluation ophtalmologique
Tout patient présentant une MS doit bénéficier d’une évaluation ophtalmologique. Il n’y a en effet pas de corrélation entre l’importance des symptômes de sécheresse oculaire perçue et la gravité de l’atteinte ophtalmologique objective. L’objectif est de détecter les formes sévères de kérato-conjonctivite.
Les larmes artificielles et les collyres lubrifiants
La prise en charge de la sécheresse oculaire comporte en première ligne des larmes artificielles et des collyres lubrifiants. Il faut impérativement privilégier les collyres sans conservateurs, ceux-ci étant irritants en cas de sécheresse oculaire. Les larmes artificielles peuvent être appliquées autant de fois que nécessaire pour soulager les symptômes. Il est recommandé de les associer à des gels lubrifiants plus épais, ayant une durée d’action plus longue. Ils s’appliquent en général plusieurs fois par jour, mais la fréquence peut être adaptée en fonction des symptômes.
Les auto-massages palpébraux
Il est également recommandé pour tous les patients d’effectuer des massages palpébraux de façon régulière pour éviter l’obstruction des glandes de Meibomius qui produisent une substance huileuse stabilisant le film lacrymal. En effet, leur obstruction chronique s’accompagne de leur involution progressive et d’un risque d’épisodes inflammatoires (blépharite).
On peut également proposer la pose de bouchons méatiques afin d’obstruer les canaux lacrymaux et ainsi éviter l’évacuation du film lacrymal et maintenir celui-ci au niveau de l’œil.
La kérato-conjonctivite sévère doit être prise en charge en milieu hospitalier ophtalmologique avec un suivi régulier pour une adaptation des traitements.
Les collyres de corticoïdes
Les collyres de corticoïdes peuvent être utilisés sur des durées brèves, au maximum 2 à 4 semaines, du fait de leur risque d’effets secondaires, notamment de glaucome cortisonique. Ils sont généralement utilisés dans les formes sévères au début du traitement afin de diminuer l’inflammation, avant de pouvoir introduire les traitements par collyres de ciclosporine qui peuvent être mal tolérés lorsque la surface oculaire est très inflammatoire.
Les collyres de sérum autologue
Dans les formes sévères ne répondant pas aux thérapeutiques précédentes, l’application de collyres de sérum autologue a été proposée avec une certaine efficacité. Toutefois, cette mesure reste un traitement de secours étant donné les difficultés de préparation et de conservation (risque infectieux).
La sécheresse génitale
La MS peut se manifester sous la forme d’une sécheresse vaginale. Ce symptôme est rarement isolé dans la maladie, mais peut apparaître très tôt, voire, plus rarement, être le symptôme d’entrée dans la maladie. Souvent négligée, car pas toujours attribuée à la maladie, elle s’installe de façon insidieuse et s’aggrave dans le temps, notamment à la ménopause et après celle-ci.
Dans le syndrome sec, les tissus vulvaires et, à moindre degré vaginaux, peuvent être le siège d’infiltrats lymphoïdes entraînant une perte de leur capacité à lubrifier, qui peut se traduire par plusieurs types de désagréments : un prurit, des brûlures vulvaires ou des dyspareunies. Souvent latents, ces symptômes s’aggravent lors de l’installation de la ménopause, la carence œstrogénique induisant une chute de la lubrification. Ces symptômes ont des conséquences importantes sur la qualité de vie sexuelle des patientes (12).
Le suivi gynécologique et les règles d’hygiène
Il est important d’aborder le sujet avec les patientes et de les orienter vers un gynécologue. Le syndrome sec vulvo-vaginal de la MS n’augmente pas le risque d’infection génitale ni de cancer génital. La prise en charge repose d’abord sur des règles d’hygiène simples (arrêt du tabac, éviter les réflexes d’“hyper-hygiène”, éviter les situations engendrant des irritations).
Les traitements hormonaux
La prescription d’un traitement hormonal substitutif (THM) à la ménopause peut améliorer l’imprégnation œstrogénique et diminuer ou prévenir la sécheresse vaginale œstrogénique. Une alternative au THM peut être l’utilisation d’ovules œstrogéniques.
Les crèmes ou ovules à l’acide hyaluronique, ou au collagène marin, les lubrifiants, selon des protocoles adaptés et personnalisés, donnent également de bons résultats.
Les perspectives thérapeutiques
La recherche est très active actuellement dans la MS, avec des essais s’adressant aussi bien à des patients présentant une activité systémique modérée à sévère (ESSDAI ≥ 5), avec ou sans symptômes, qu’à ceux présentant une “charge symptomatique élevée” et une faible activité systémique. Plusieurs essais de phase II ou III retrouvent des résultats intéressants sur le syndrome sec avec parfois une augmentation du débit salivaire.
Le ianalumab
Le ianalumab (anticorps monoclonal anti-BAFF récepteur) est la première immunothérapie administrée dans le cadre d’un essai randomisé, contrôlé, en double aveugle, qui a permis de réduire de manière dose-dépendante l’activité de la maladie et d’augmenter le flux salivaire stimulé au cours d’une période de traitement de 24 semaines (13). Un essai de phase III, s’adressant à des patients avec une charge symptomatique élevée et une faible activité systémique, est en projet.
L’iscalimab
L’axe CD40/CD40 ligand, impliqué dans les réponses immunitaires innées et humorales, dont l’activation lymphocytaire B, est également une piste thérapeutique prometteuse ; l’essai de phase II TWINSS (14) a permis d’évaluer la sécurité et l’efficacité de doses multiples d’iscalimab, un anticorps monoclonal reconnaissant le CD40. Dans la première cohorte, 173 patients présentant à la fois une activité systémique modérée ou élevée et des symptômes importants ont été randomisés entre le placebo et l’iscalimab 150, 300 ou 600 mg. Dans la seconde cohorte, 100 patients présentant une activité systémique faible et des symptômes importants ont été randomisés entre le placebo et l’iscalimab 600 mg. Dans la première cohorte, l’activité systémique de la maladie s’est améliorée avec les trois doses de traitement, de façon significative pour les doses de 150 mg et 600 mg. Dans la seconde cohorte, une tendance à l’amélioration des symptômes de la maladie a été observée avec l’iscalimab. Les débits salivaires stimulés et non stimulés se sont améliorés avec l’iscalimab.
Le dazodalibep
Des résultats intéressants ont également été publiés avec le dazodalibep (protéine de fusion anti-CD40 ligand). L’administration mensuelle du traitement sur une période de 169 jours dans deux cohortes (activité systémique élevée (cohorte 1) et faible activité systémique, mais charge symptomatique élevée (cohorte 2)), améliore significativement l’activité systémique de la maladie (cohorte 1) et le score ESSPRI (cohorte 2) par rapport au placebo (15). La composante sécheresse du score ESSPRI était significativement améliorée dans la cohorte 2, mais sans amélioration significative du flux salivaire stimulé.
Ces résultats laissent entrevoir la possibilité de disposer d’un traitement dans la MS aussi bien pour des patients présentant des complications systémiques que chez ceux ayant une charge symptomatique élevée, avec parfois un syndrome sec ayant un fort retentissement sur la vie quotidienne.
L’auteur déclare ne pas avoir de liens d’intérêt en rapport avec cet article.
Bibliographie
1. Warner BM, Baer AN, Lipson EJ et al. Sicca syndrome associated with immune checkpoint inhibitor therapy. Oncologist 2019 ; 24 : 1259-69.
2. Mariette X, Caudmont C, Berge E et al. Dry eyes and mouth syndrome or sicca, asthenia and polyalgia syndrome? Rheumatology 2003 ; 42 : 914.
3. Mariette X, Criswell LA. Primary Sjögren’s syndrome. N Engl J Med 2018 ; 378 : 931-9.
4. Seror R, Ravaud P, Mariette X et al. EULAR Sjogren’s syndrome patient reported index (ESSPRI): development of a consensus patient index for primary Sjogren’s syndrome. Ann Rheum Dis 2011 ; 70 : 968-72.
5. Seror R, Ravaud P, Bowman SJ et al. EULAR Sjogren’s syndrome disease activity index: development of a consensus systemic disease activity index for primary Sjogren’s syndrome [published correction appears in Ann Rheum Dis 2011 ; 70 : 880]. Ann Rheum Dis 2010 ; 69 : 1103-9.
6. Shiboski CH, Shiboski SC, Seror R et al. 2016 American College of Rheumatology/European League Against Rheumatism classification criteria for primary Sjögren’s syndrome: A consensus and data-driven methodology involving three international patient cohorts. Ann Rheum Dis 2017 ; 76 : 9-16.
7. Jousse-Joulin S, Gatineau F, Baldini C et al. Weight of salivary gland ultrasonography compared to other items of the 2016 ACR/EULAR classification criteria for Primary Sjögren’s syndrome. J Intern Med 2020 ; 287 : 180-8.
8. Al Tabaa O, Gouze H, Hamroun S et al. Normal salivary gland ultrasonography could rule out the diagnosis of Sjögren’s syndrome in anti-SSA-negative patients with sicca syndrome. RMD Open 2021 ; 7 : e001503.
9. Mariette X, Devauchelle V, Benyoussef A et al. Protocole national de diagnostic et de soins – Maladie (ou syndrome de Sjogren), 2022.
10. Gottenberg JE, Ravaud P, Puéchal X et al. Effects of hydroxychloroquine on symptomatic improvement in primary Sjögren syndrome: the JOQUER randomized clinical trial. JAMA 2014 ; 312 : 249-58.
11. Wu J, Li D. Pilocarpine treatment of Sjögren’s syndrome curative effect of meta-analysis of randomised controlled trials. Clin Exp Rheumatol 2024 ; 42 : 2490-8.
12. Kachaner A, Seror R, Le Guern V et al. Impact of Sjögren’s disease on quality of sexual life using the Qualisex score. RMD Open 2025 ; 11 : e004693.
13. Bowman SJ, Fox R, Dörner T et al. Safety and efficacy of subcutaneous ianalumab (VAY736) in patients with primary Sjögren’s syndrome: a randomised, double-blind, placebo-controlled, phase 2b dose-finding trial. Lancet 2022 ; 399 : 161-71.
14. Fisher BA, Mariette X, Papas A et al. Safety and efficacy of subcutaneous iscalimab (CFZ533) in two distinct populations of patients with Sjögren’s disease (TWINSS): week 24 results of a randomised, double-blind, placebo-controlled, phase 2b dose-ranging study. Lancet 2024 ; 404 : 540-53.
15. St Clair EW, Baer AN, Ng WF et al. CD40 ligand antagonist dazodalibep in Sjögren’s disease: a randomized, double-blinded, placebo-controlled, phase 2 trial. Nat Med 2024 ; 30 : 1583-92.




