Nous connaissons tous l’importante activité de notre ami Michel Laroche dans le domaine de la pathologie osseuse, et l’angle souvent très original de ses analyses et de sa démarche. Ainsi, Michel met en place depuis quelques années un réseau régional sur l’ostéoporose, visant à en promouvoir son dépistage et sa prise en charge précoce.
L’un des obstacles majeurs de cette prise en charge est l’inquiétude véhiculée notamment par les dentistes au sujet des risques d’ostéonécrose de la mandibule sous traitements anti-résorbeurs. Michel et les membres de son réseau, auxquels se sont associés des spécialistes de l’odontologie, nous proposent dans ce dossier des conduites pratiques pour prévenir le risque d’ostéonécrose de la mandibule, et pour diffuser une information de qualité auprès de nos correspondants.
Nous pourrons tous nous inspirer de ce précieux document !
Pr Thierry Schaeverbeke, rédacteur en chef
Ces recommandations “régionales” ont été réalisées après lecture des recommandations nationales de la Société française de stomatologie, chirurgie maxillo-faciale et chirurgie orale de 2012 (2) et 2013 (3) et lecture de deux articles concernant ce sujet (4, 5), de façon consensuelle par :
• Pr Michel Laroche et Dr Guillaume Couture, rhumatologues au Centre de rhumatologie du CHU de Toulouse ;
• Dr Elsa Poix, rhumatologue à la Clinique Croix du Sud à Quint-Fonsegrives ;
• Pr Sarah Cousty, chirurgien oral, service d’odontologie du CHU de Toulouse, Université Paul Sabatier ;
• Dr Sara Laurencin, maître de conférences des universités en parodontologie, service d’odontologie du CHU de Toulouse, Université Paul Sabatier ;
• Dr Leonor Costa-Mendes, chirurgien oral, assistante hospitalo-universitaire, service d’odontologie du CHU de Toulouse, Université Paul Sabatier ;
• Dr Marie Georgelin-Gurgel, maître de conférences des universités en endodontie, service d’odontologie du CHU de Toulouse, Université Paul Sabatier
• Dr Ségolène Georg, praticien hospitalier dans le service de chirurgie maxillo-faciale du CHU de Toulouse ;
• Dr Jean Pierre Luro, chirurgien-dentiste à Labège ;
• Dr Vincent Benouaich, chirurgien-dentiste à Toulouse.

Conduites à tenir devant un malade ayant une ostéoporose devant être traitée par anti-résorbeurs (bisphosphonates ou dénosumab)
Malade nécessitant un traitement et un suivi régulier par son chirurgien-dentiste
Ayant été examiné par son chirurgien-dentiste (CD) depuis moins de 1 an, n’ayant ni saignements gingivaux, ni douleurs dentaires, ni sensation de mobilité dentaire.
Pas de consultation systématique avec le CD avant le début du traitement : adresser un courrier au CD traitant pour l’informer du traitement.
Malade nécessitant un traitement et n’ayant pas de suivi dentaire rigoureux
Ou présentant l’un des symptômes suivants : saignements gingivaux, douleurs dentaires, sensations de mobilité dentaire, migrations/déplacements dentaires récents, halitose.
Consultation chez le CD.
Si ostéoporose densitométrique
Risque fracturaire faible.
• Avulsions dentaires à réaliser avant le début du traitement.
• Début du traitement dès cicatrisation : cicatrisation muqueuse complète (environ 15 jours).
• Consultation de contrôle par dentiste traitant à 3 mois (contrôler cicatrisation osseuse).
Si ostéoporose fracturaire, notamment avec fracture récente (moins de 2 ans)
Risque fracturaire ultérieur important.
Pas d’avulsions ou d’implants envisagés
Début du traitement
Avulsions ou implants envisagés
Début du traitement par bisphosphonates per os et réalisations des soins sous traitement (bien que le risque d’ostéonécrose de la mâchoire (ONAM) dépende plus de la durée de traitement que de la voie d’administration, la fixation mandibulaire du bisphosphonate sera plus progressive qu’après une perfusion de zolédronate).
Si le risque de fracture de hanche est faible et s’il s’agit d’une femme de moins de 70 ans
Le raloxifène peut être prescrit.
Si le malade a plus de deux fractures vertébrales
Le tériparatide peut être prescrit.
Une fois les soins terminés
Relais par perfusion de zolédronate ou dénosumab, si le rhumatologue juge que ces options thérapeutiques sont préférables au bisphosphonate per os ou au raloxifène.
Durée
Les contre-indications locales et/ou générales à la réhabilitation implantaire sont identiques avec ou sans traitement par bisphosphonates. Elles restent à évaluer avant tout traitement, par le dentiste traitant.
Malade ayant une ostéoporose traitée par bisphosphonates
Le risque d’ONAM dépend plus de la durée de traitement que de sa forme (orale ou IV). Il est dose-durée-dépendant.
Les avulsions
Elles sont réalisables avec certaines précautions : une récente étude prospective (1 480 avulsions dentaires chez 700 patients ostéoporotiques traités par bisphosphonates) n’a montré aucun cas d’ONAM. Il s’agit de réduire l’inflammation, voire l’infection locale, par des mesures d’assainissement parodontal (détartrage, polissage, débridement parodontal, surfaçage) préalablement à la chirurgie et par des bains de bouche quotidiens à la chlorhexidine (0,20 % bactéricide et antiseptique), avec une antibioprophylaxie pré et postopératoire.
La pose d’implants
Elle peut être effectuée avec certaines précautions :
• prophylaxie AB (amoxicilline ou clindamycine) avec prise la veille de l’intervention puis jusqu’à cicatrisation complète (si nécessaire plusieurs jours en postopératoire) ;
• technique opératoire atraumatique (retrait aussi minime que possible du périoste) ;
• guérison primaire des plaies de tissu mou et osseux ;
• régularisation des bords osseux tranchants ;
• surveillance prolongée de la cicatrisation puis suivi régulier avec maintenance afin de détecter précocement et de traiter, si nécessaire, tout signe d’inflammation péri-implantaire.
Dans ce contexte, les implants sont contre-indiqués en cas d’intoxication tabagique, alcoolique, dénutrition, mauvaise hygiène bucco-dentaire.

Cas particulier du zolédronate (Aclasta®)
Si le malade est traité par zolédronate et si une avulsion ou une pose d’implants doit être réalisée aux alentours de la date prévue de la perfusion, il n’y a aucun risque, en ce qui concerne l’ostéoporose et le risque fracturaire, à repousser cette perfusion de 1 ou 2 mois.
Cas particulier du dénosumab (Prolia®)
Le risque d’ONAM semble sensiblement identique à celui induit par les bisphosphonates, mais le recul est moindre (médicament commercialisé en France depuis 2012) et les études de cohorte moins nombreuses. Il semble que certaines ONAM puissent survenir en début de traitement. Si des soins dentaires importants doivent être réalisés : plusieurs avulsions simultanées, implants ou si le malade a des facteurs de risque d’ONAM (corticothérapie, alcoolo-tabagisme), si l’état dentaire le permet, le CD peut attendre 6 mois après l’injection précédente pour effectuer les avulsions, car le dénosumab n’a pas d’effet rémanent et le remodelage osseux revient à la normale dès ces 6 mois. Il faudra reprendre le traitement dès cicatrisation (osseuse, donc 3 à 6 mois), car l’arrêt plus prolongé du dénosumab va engendrer une perte osseuse et un risque de fracture ostéoporotique. Ceci après avoir pris l’avis du rhumatologue ayant prescrit le Prolia®.
Cas particulier du tériparatide (Forstéo®)
Il n’existe aucun risque d’ONAM (ce médicament est utilisé avec succès dans le traitement de ces dernières). Si pas de suivi régulier par le CD : prévoir consultation pour effectuer les soins pendant ce traitement (durée : 18 mois), avant le relais par bisphosphonates ou dénosumab.
Cas particulier du raloxifène (Optruma®, Evista®)
Il n’y a aucun risque d’ONAM. Si pas de suivi régulier par le CD : prévoir consultation pour effectuer les soins pendant ce traitement, avant le relais par bisphosphonates ou dénosumab si ces traitements doivent remplacer le raloxifène.
ONAM lors des cancers métastatiques ou du myélome traités par bisphosphonates ou dénosumab
Ces maladies et leurs traitements s’opposent point par point à l’ostéoporose :
• le risque d’ONAM est 100 fois plus fréquent que dans l’ostéoporose ;
• les ONAM y sont beaucoup plus graves du fait du contexte néoplasique et des chimiothérapies ;
• l’efficacité des anti-résorptifs vis-à-vis des complications engendrées par les métastases osseuses est modérée. Ces médicaments n’améliorent pas la survie du malade ;
• les doses de bisphosphonates ou de dénosumab y sont 10 fois supérieures à celles utilisées dans l’ostéoporose.
Chez ces malades, aucun risque d’ONAM ne doit être pris. Aucun traitement ne doit être débuté avant consultation chez le CD et panoramique dentaire, les soins dentaires doivent être terminés lorsque le traitement est débuté. Les implants sont contre-
indiqués. En cas de nécessité d’avulsion, le traitement doit être stoppé.
Ce que doit savoir le chirurgien-dentiste sur l’ostéoporose
L’ostéoporose est une maladie favorisant le risque de fractures spontanées ou par traumatisme minime (chute de sa hauteur). Elle atteint, en France, 40 % des femmes ménopausées et 10 % des hommes de plus de 60 ans. Les fractures ostéoporotiques concernent principalement les vertèbres, le col du fémur, le poignet. L’ostéoporose est parfois secondaire (5 % des cas chez la femme, 30 % chez l’homme) à d’autres affections : corticothérapie, hyperthyroïdie, hyperparathyroïdie, hypogonadisme chez l’homme, tubulopathies rénales. Elle a des facteurs de risque communs avec les lésions carieuses et parodontales : alcool, tabac, diabète, corticoïdes.
Risques et sévérité
Les fractures ostéoporotiques peuvent être graves :
En termes de morbidité :
• seules 50 % des femmes âgées ayant eu une fracture du col fémoral pourront retrouver une autonomie permettant la vie à domicile ;
• les femmes ayant eu plusieurs fractures/tassements vertébraux ont une cyphose, des dorsalgies, une insuffisance respiratoire.
Et de mortalité : on meurt plus après une fracture du col du fémur ou après plusieurs fractures vertébrales qu’après un infarctus du myocarde.
Le risque de fracture, et donc la gravité de l’ostéoporose, dépend de l’importance de la baisse de la densité minérale osseuse mesurée par ostéodensitométrie, mais aussi et surtout des antécédents de fractures ostéoporotiques et de l’âge des malades. Par exemple, le risque d’avoir une fracture dans l’année qui suit sera de 0,5 % chez une femme de 55 ans ayant une densité osseuse abaissée de 10 %, mais il sera de 30 % chez une femme de 70 ans venant de présenter un tassement vertébral. L’urgence thérapeutique concernant la déminéralisation et la prise en compte de l’état dentaire pourra ainsi être totalement différente selon le malade.
Il convient donc que le CD interroge le malade sur le type d’ostéoporose qu’il présente (densitométrique ou fracturaire).
Traitements
Plusieurs traitements peuvent être utilisés et leur efficacité a été clairement démontrée par toutes les études randomisées contre placebo :
• diminution de 70 % du risque de fracture vertébrale et de 40 % du risque de fracture de hanche pour le zolédronate et le dénosumab ;
• diminution de 28 % de la mortalité après fracture du col fémoral pour le zolédronate chez des malades âgées.
Le tériparatide (Forstéo®) n’induit pas de risque d’ONAM, mais il ne peut être prescrit qu’en cas de double fracture vertébrale sur une durée ne dépassant pas 18 mois.
Le raloxifène n’induit pas, lui non plus, de risque d’ONAM, mais il ne réduit pas le risque de fracture de hanche et il est moins efficace dans la prévention des fractures vertébrales que les bisphosphonates. Il n’est pas conseillé après 65 ans.
Épidémiologiquement, selon les recommandations de l’OMS et de l’ANAES, 40 % des femmes et 10 % des hommes devraient avoir au cours de leur vie un traitement par bisphosphonates ou dénosumab. Il est donc illusoire de ne pas vouloir réaliser d’avulsions dentaires ou d’implants chez ces malades d’autant que les recommandations de la Société française de stomatologie et de chirurgie maxillo-faciale l’y autorisent.
Ce que doit savoir le chirurgien-dentiste sur l’ONAM favorisée par les bisphosphonates et le dénosumab
Différents médicaments anti-résorptifs peuvent induire une ONAM. Il s’agit des bisphosphonates ou de thérapies ciblées telles que le dénosumab. Les bisphosphonates (Tab. 1) sont utilisés en oncologie et pour le traitement de pathologies bénignes, notamment l’ostéoporose et la maladie de Paget. Ils peuvent être administrés par voie per os ou intra-veineuse, indépendamment de la pathologie traitée. Le dénosumab est administré uniquement par voie sous-cutanée. Il est commercialisé sous le nom de Xgeva®, utilisé en oncologie, et de Prolia® pour le traitement de l’ostéoporose.
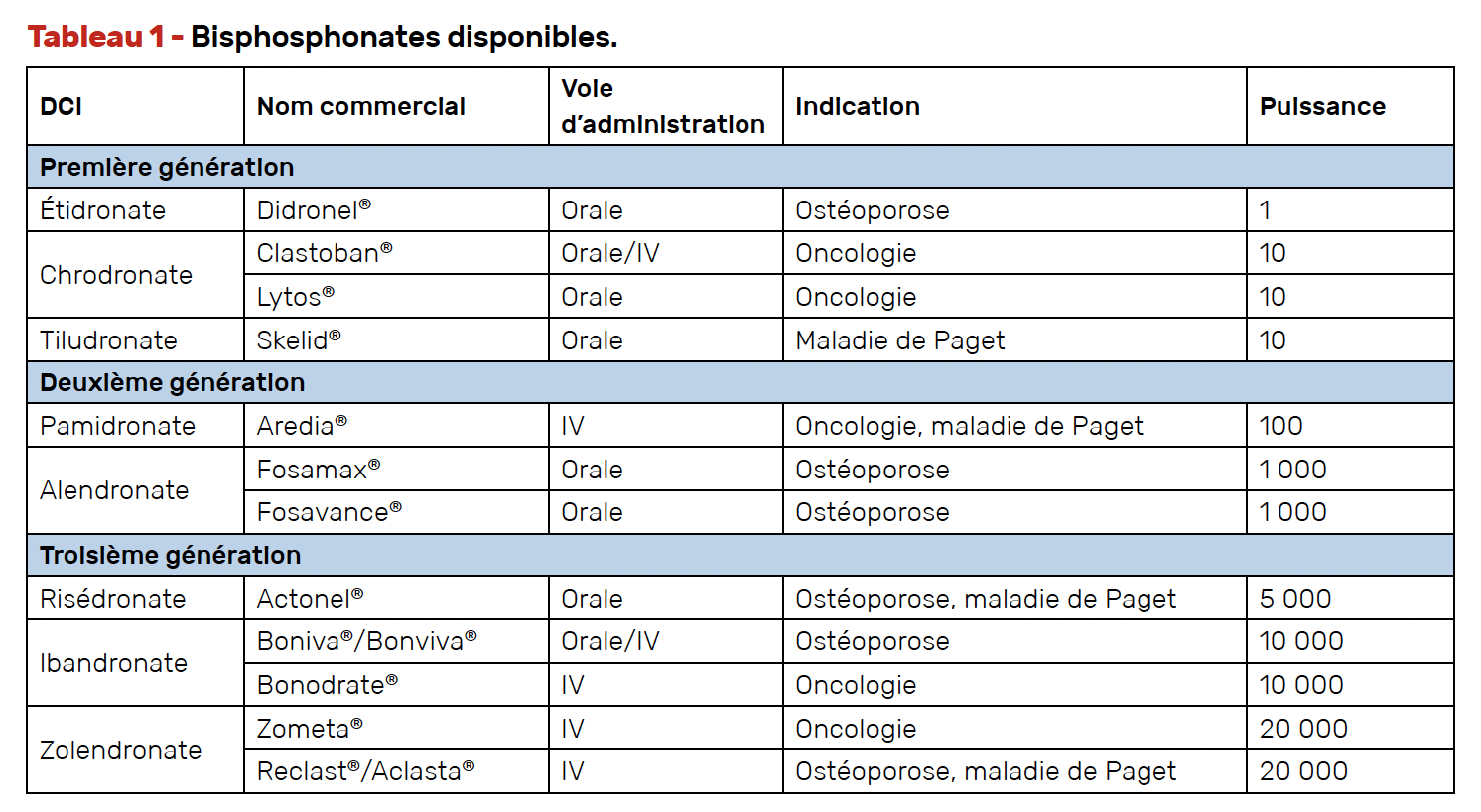
Définition (6)
Une ostéonécrose des maxillaires induite par bisphosphonates ou dénosumab peut être décrite par les quatre critères suivants :
• lésion de la muqueuse au niveau de la région maxillo-faciale mettant à nu l’os nécrosé, persistant depuis plus de 8 semaines ;
• traitement par bisphosphonates ou dénosumab antérieur ou en cours ;
• absence d’antécédent d’irradiation crânio-faciale ;
• absence de localisation métastatique au niveau de la zone d’ONAM.
D’un point de vue radiologique, l’ONAM se manifeste par une zone de lyse osseuse, de déminéralisation diffuse, l’absence de cicatrisation d’une alvéole d’extraction, ou par la formation d’un séquestre osseux.
Facteurs de risque
L’estimation du risque de développer une ONAM se fondera sur :
• la puissance de la molécule (génération de bisphosphonates notamment) ;
• la biodisponibilité de la molécule (voie d’administration : IV/sous cutanée/per os) ;
• la durée de traitement.
En effet, il y a une notion d’effet cumulatif, puisque le risque augmente avec le temps de traitement, la puissance de la molécule et la voie d’administration.
La biodisponibilité de la molécule, et donc sa fixation au niveau osseux, est plus importante lors d’administration IV ou sous-cutanée.
On estime que le risque de développer une ONAM devient significatif après 4 ans de traitement par alendronate (bisphosphonate de 2e génération administré par voie orale) et 18 mois pour le zolédronate (bisphosphonate de 3e génération administré par voie IV).
Examens complémentaires
En cas de suspicion d’ONAM ou d’ONAM avérée (exposition osseuse, retard de cicatrisation d’une alvéole d’extraction, présence d’un séquestre osseux ou d’une lyse osseuse visibles radiologiquement), il est conseillé de réaliser un orthopantomogramme ainsi qu’une imagerie tridimensionnelle de type Cone Beam CT ou scanner maxillo-mandibulaire et d’adresser le patient à un praticien spécialisé.


Ce que doit connaître le rhumatologue des principales pathologies dentaires favorisant l’ONAM et de l’ONAM
Principales pathologies dentaires favorisant l’ONAM
Thérapeutique endodontique
Cette thérapeutique vise à soigner ou à éliminer un tissu inflammatoire ou infecté du réseau canalaire dentaire, afin d’assurer le maintien de la santé osseuse périradiculaire. En cas d’atteinte du tissu osseux, on parle de lésion inflammatoire périradiculaire d’origine endodontique (ou LIPOE) ; celle-ci pourra être aiguë ou chronique.
• Si le diagnostic de LIPOE est posé avant le traitement anti-résorptif, une thérapeutique endodontique devra être menée à bien. La cicatrisation de cette lésion osseuse peut être observée au plus tôt à 3 mois après le soin, l’absence de signe clinique associé confirme le succès de la thérapeutique.
• Si le diagnostic de LIPOE est posé pendant le traitement antirésorptif, le traitement endodontique en une seule séance pourra être envisagé sous antibioprophylaxie, s’il est simple à mener et de bon pronostic. Un traitement endodontique chirurgical associant une exposition osseuse est contre-indiqué.
Maladie parodontale
Les parodontites sont des pathologies orales inflammatoires chroniques liées à un déséquilibre entre le facteur étiologique bactérien (dysbiose) et les défenses immunitaires de l’hôte. Elles entraînent une destruction des tissus de soutien de la dent (os alvéolaire, cément, ligament parodontal) et une migration apicale du système d’attache parodontale conduisant ainsi à la formation de l’entité pathognomonique de la maladie, la lésion ou la poche parodontale (7, 8).
Épidémiologie
La prévalence des parodontites est élevée et augmente avec l’âge (9). La parodontite chronique sévère concerne jusqu’à 20 % de la population adulte mondiale selon l’OMS, ce qui la positionne en sixième place des affections chroniques les plus répandues (10). En France, près d’un million de personnes présenteraient des pertes d’attache d’au moins 7 mm (9) dans la tranche d’âge 35-65 ans.
Diagnostic
Le diagnostic de la parodontite est surtout clinique et radiologique. D’un point de vue clinique, on retrouve des saignements gingivaux (spontanés ou provoqués), des suppurations, des douleurs diffuses, des signes d’inflammation gingivale (gingivite), des migrations dentaires, des récessions gingivales, des mobilités, voire des pertes dentaires spontanées et une halitose. Radiologiquement, la lyse osseuse sera visible.
Traitement
Le traitement de la parodontite consiste à restaurer l’équilibre buccal en éliminant le biofilm des poches, en décontaminant la surface radiculaire dentaire afin de permettre la réattache (cicatrisation du système d’ancrage de la dent). Ce traitement est dans un premier temps non chirurgical et ensuite, dans certains cas, chirurgical.
Sans prise en charge thérapeutique, l’évolution de la pathologie peut conduire à la perte des dents, entraînant un altération de la qualité de vie des patients et des difficultés de réhabilitation de la cavité orale (7). Outre les conséquences sociales, les parodontites participent donc à aggraver les coûts directs et indirects de santé (10).
Implant
Un implant dentaire est un dispositif médical placé dans l’os alvéolaire maxillaire ou mandibulaire afin de créer un ancrage pour une prothèse fixée ou amovible. La prise d’anti-résorptifs osseux peut compliquer le processus de cicatrisation osseuse suite à la pose des implants, compromettre leur ostéointégration, voire mener au développement d’une ONAM. De même, la survenue d’une infection péri-implantaire chez un patient traité par bisphosphonates ou dénosumab peut mener à une ONAM. Celle-ci peut se traduire par des douleurs, une inflammation de la muqueuse péri-implantaire, des saignements, un écoulement purulent ou une mobilité de l’implant.
Avulsion ou traumatisme
Entre 40 à 85 % des ONAM surviennent suite à un geste traumatique ou invasif de la muqueuse orale ou de l’os alvéolaire. Dans 37,8 % des cas, ce geste est une avulsion dentaire.
L’absence de cicatrisation d’une alvéole dentaire 8 semaines après une avulsion doit faire évoquer une ONAM. De même, une prothèse amovible inadaptée peut entraîner des traumatismes répétés et des blessures de la muqueuse amenant à l’exposition de l’os sous-jacent et au risque de développer une ONAM.
ONAM
Manifestations cliniques
Une ONAM peut se manifester sous différentes formes :
• une exposition osseuse,
• une absence de cicatrisation suite à une chirurgie de la cavité orale (alvéole d’extraction déshabitée),
• des douleurs,
• une infection focale ou loco-régionale (sinusite maxillaire, cellulite),
• une fracture pathologique,
• une communication bucco-sinusienne ou bucco-nasale.
Diagnostic
Le diagnostic sera essentiellement clinique, avec la mise en évidence d’une exposition osseuse persistant depuis plus de 8 semaines. Radiologiquement, une ONAM pourra être évoquée en présence d’une zone de lyse osseuse, de déminéralisation diffuse, d’un séquestre osseux ou en l’absence de cicatrisation d’une alvéole d’extraction.
Traitement
Le traitement aura comme objectifs la prise en charge palliative des symptômes, le contrôle de l’infection et la limitation de l’extension de la zone d’ostéonécrose. Selon le stade de l’ONAM, son incidence sur la qualité de vie et l’état général du patient, différentes approches seront proposées. L’intérêt de l’interruption du traitement par bisphosphonates ou dénosumab doit être discuté au cas par cas.
• La prise en charge conservatrice visera à contrôler l’infection et à soulager les signes fonctionnels par un traitement antibiotique, l’utilisation d’antiseptiques locaux, l’élimination des foyers infectieux dentaires actifs, l’instauration d’une hygiène bucco-dentaire optimale et d’une surveillance régulière.
• Une prise en charge chirurgicale peut être également envisagée d’emblée ou en cas d’échec de la thérapeutique conservatrice (extension des lésions osseuses, persistance ou aggravation des douleurs et des signes fonctionnels). Elle consistera en une résection de l’os nécrotique et une fermeture hermétique de la muqueuse.
Un suivi régulier par un spécialiste doit être instauré en cas d’ONAM avérée, avec des contrôles cliniques et/ou radiologiques tous les 3 mois. Une évolution péjorative de la pathologie se manifestera par une majoration des signes fonctionnels, des troubles de la sensibilité labio-mentonnière, une infection loco-régionale (cellulite cervico-faciale, sinusite maxillaire), une fracture pathologique, l’apparition d’un orostome, d’une communication bucco-nasale ou bucco-sinusienne.
L’auteur déclare faire des interventions ponctuelles avec Amgen.
Bibliographie
1. Ruggiero SL, Dodson TB, Aghaloo T et al. American Association of Oral and Maxillofacial Surgeons’ position paper on medication-related osteonecrosis of the jaws-2022 update. J Oral Maxillofac Surg 2022 ; 80 : 920-43.
2. Société française de stomatologie, chirurgie maxillo-faciale et chirurgie orale. Implantologie et bisphosphonates. Recommandations de bonne pratique. Juillet 2012.
3. Société française de stomatologie, chirurgie maxillo-faciale et chirurgie orale. Ostéonécrose des mâchoires en chirurgie oromaxillofaciale et traitements médicamenteux à risque (anti-résorbeurs osseux, antiangiogéniques). Recommandations de bonne pratique. Juillet 2013.
4. Khan AA, Sandor GKB, Dore E et al. Canadian consensus practice guidelines for bisphosphonate associated osteonecrosis of the jaw. J Rheumatol 2008 ; 35 : 1391-7.
5. Khan AA, Morrison A, Hanley DA et al. Diagnosis and management of osteonecrosis of the jaw: a systematic review and international consensus. J Bone Miner Res 2015 ; 30 : 3-23.
6. Afssaps. Recommandations sur la prise en charge bucco-dentaire des patients traités par bisphosphonates. Lettres aux professionnels de santé. 18 décembre 2007.
7. Nanci A, Bosshardt DD. Structure of periodontal tissues in health and disease. Periodontol 2000 2006 ; 40 : 11-28.
8. Kinane DF, Bartold PM. Clinical relevance of the host responses of periodontitis. Periodontol 2000 2007 ; 43 : 278-93.
9. Bourgeois D, Bouchard P, Mattout C. Epidemiology of periodontal status in dentate adults in France, 2002-2003. J Periodontal Res 2007 ; 42 : 219-27.
10. Tonetti MS, Jepsen S, Jin L, Otomo-Corgel J. Impact of the global burden of periodontal diseases on health, nutrition and wellbeing of mankind: A call for global action. J Clin Periodontol 2017 ; 44 : 456-62.




