La solidité osseuse repose sur l’intégration de deux facteurs principaux : la densité et la qualité osseuses. La mise en défaut de cette résistance osseuse conduit à un risque plus élevé d’événements fracturaires survenant en particulier à l’occasion de traumatismes dits à bas niveaux d’énergie, dont l’archétype est la chute de sa hauteur. Cette fragilité osseuse ostéoporotique a pendant longtemps été considérée comme l’apanage du genre féminin. Il n’en est rien et l’ostéoporose masculine est à l’origine d’un fardeau important pour la santé des hommes (1).
Résumé
• L’ostéoporose masculine demeure une condition importante tant sur le plan clinique qu’économique, et ce, d’autant plus qu’elle est largement sous-diagnostiquée et sous-traitée.
• Il existe des recommandations françaises de prise en charge et tout homme ayant déjà subi une fracture de fragilité osseuse devrait être traité en adaptant le schéma thérapeutique au risque initial de fracture.
Abstract
Male osteoporosis: An update
• Male osteoporosis remains a clinically and economically important condition, all the more so as it is largely under-diagnosed and under-treated.
• There are French recommendations for its management, and any man who has already suffered a fragility fracture should be treated by adapting the treatment regimen to the initial risk of fracture.
Épidémiologie
Incidence et prévalence
Chez l’homme, l’espérance de vie plus faible, l’absence d’équivalent de la ménopause et l’existence d’un pic de masse osseuse plus élevé sont les trois principaux facteurs expliquant la moindre incidence de l’ostéoporose (2). On estime cependant qu’un homme sur cinq âgés de plus de 50 ans aura une fracture ostéoporotique d’ici à la fin de sa vie (3). Entre 2002 et 2013, en France, le nombre de patients ayant fait l’objet d’une chirurgie pour fracture de l’extrémité supérieure du fémur a augmenté de 5 % chez les femmes et de 22 % chez les hommes passant respectivement de 49 287 à 50 215 et de 12 716 à 15 482 (4). Dans les deux sexes, avec l’âge, l’incidence des fractures vertébrales augmente. À l’âge de 50-60 ans, la plupart des études indiquent que la prévalence des fractures vertébrales chez l’homme est voisine, voire supérieure à celle de la femme. Ainsi, dans la population européenne standardisée pour l’âge, la prévalence des fractures vertébrales était de 12,2 % chez l’homme est de 12 % chez la femme dans la tranche d’âge de 50-79 ans (5).
Mortalité
Les taux de mortalité après fracture diffèrent entre les deux genres. Les hommes ont en effet un risque de décès après fracture bien plus élevé que les femmes. Dans un groupe de femmes et d’hommes âgés de plus de 60 ans, la mortalité à la suite d’une hospitalisation pour une fracture de hanche était de 4,7 % chez les femmes, mais de 10,2 % chez les hommes. De plus, à 1 an après cet événement, la mortalité était de 28,2 % chez les femmes contre 37,5 % chez les hommes (6). Il est important de savoir que ce surrisque de mortalité peut persister pendant 10 ans (7).
Causes de l’ostéoporose chez l’homme
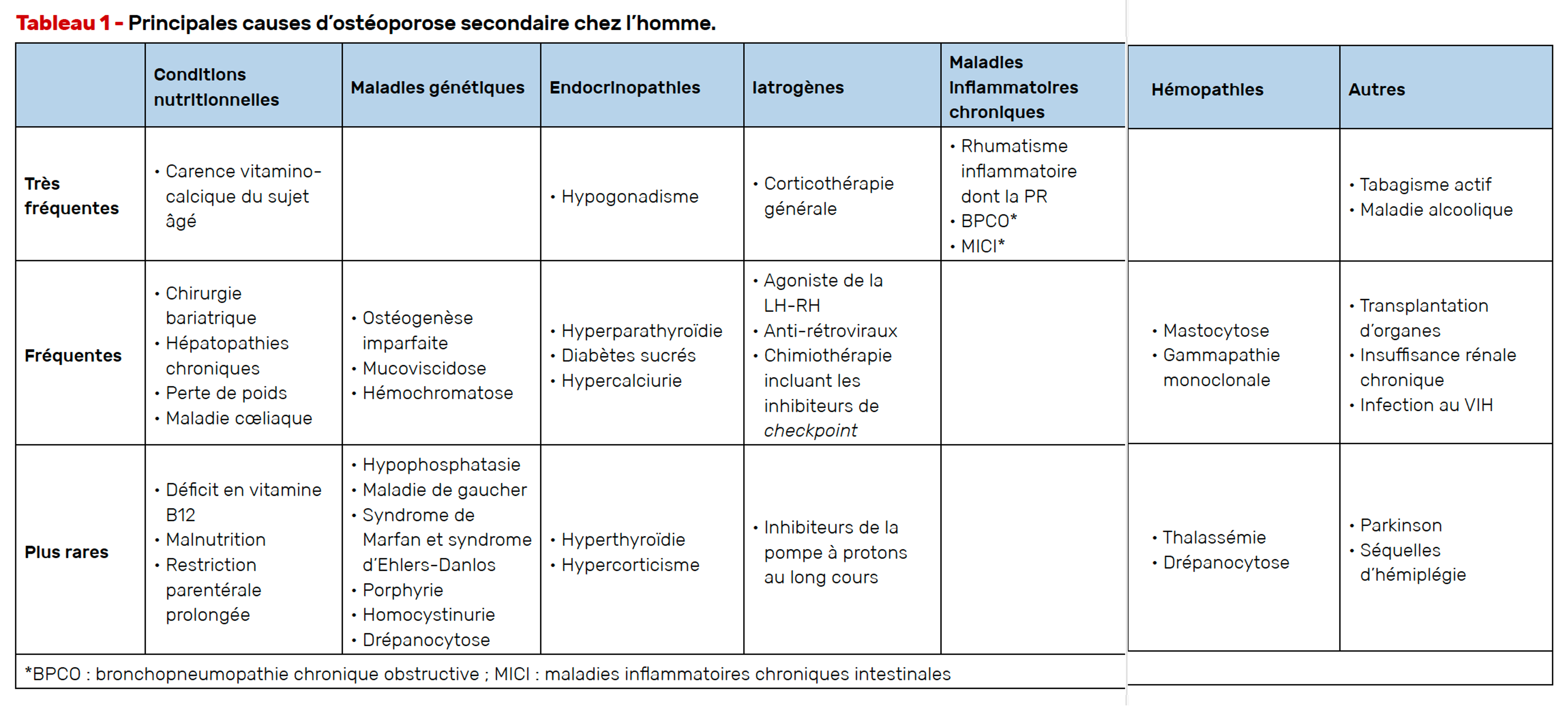
Les causes secondaires de l’ostéoporose chez l’homme sont plus fréquentes que chez la femme. En effet, chez la femme une cause secondaire peut être trouvée dans 20 à 50 % des cas alors que chez l’homme une cause spécifique peut être mise en évidence dans 40 à 60 % des cas.
Les principales causes d’ostéoporose chez l’homme
Dans la population masculine, les trois principales et plus fréquentes causes d’ostéoporose sont :
• un hypogonadisme souvent associé aux traitements antiandrogéniques utilisés dans le traitement du cancer de la prostate,
• mais aussi l’excès de boissons alcoolisées
• et l’usage chronique des glucocorticoïdes.
De très nombreuses autres causes sont décrites dans le tableau 1.
Interrogatoire et évaluation clinique
La grande fréquence de la présence d’une étiologie secondaire à l’ostéoporose masculine justifie un interrogatoire attentif incluant la liste complète des traitements pharmacologiques pris par les patients, une évaluation clinique soigneuse qui, outre le poids et la taille, s’intéressera aux signes cliniques d’hypogonadisme. En effet, il a été estimé qu’approximativement 20 % de la population des hommes âgés ostéoporotiques avaient une baisse des hormones masculines (8).
La sarcopénie
L’hypogonadisme chez l’homme âgé associé à d’autres causes induisant également de l’ostéoporose peut aussi participer au développement d’une sarcopénie (9). Il est d’ailleurs démontré que l’association sarcopénie et ostéoporose chez l’homme augmente le risque de fracture du fait de troubles de l’équilibre, favorisés par une perte de force musculaire qui augmente le risque de chute et contribue donc à l’augmentation du risque de fracture de fragilité osseuse (10). Dans la cohorte anglaise UK-Biobank, 400 000 patients, dont environ 45 % d’hommes, ont été étudiés avec un suivi médian de 12 ans. Le risque de fracture incidente en fonction de l’état pré-sarcopénique ou sarcopénique des patients était évalué. Les résultats, avec des hazard ratios variant de 1,18 à 1,30, étaient significatifs traduisant le lien entre le risque de fracture et la sarcopénie (11).
Évaluations biologiques
Les évaluations biologiques qui figurent ci-dessous pourraient être demandées pour préciser d’éventuelles causes d’ostéoporose chez l’homme :
• numération formule sanguine,
• créatinine,
• calcémie,
• phosphatémie,
• dosage des phosphatases alcalines,
• tests de la fonction hépatique,
• testostéronémie,
• 25OH vitamine D,
• TSH.
Ainsi que, dans les urines de 24 heures,
• dosage du calcium,
• du sodium
• et de l’excrétion de la créatine.
Il a été identifié que ce type d’exploration permettrait l’identification de près de 90 % des causes de l’ostéoporose masculine (12).
Une étude effectuée à partir de la cohorte MrOs a cependant établi que la plupart des explorations biologiques effectuées pour évaluer et faire le diagnostic des maladies métaboliques osseuses sont d’une utilité clinique faible en dehors du dosage de la vitamine D et des phosphatases alcalines (13).
Plus l’ostéoporose densitométrique ou la fracture survient chez un homme jeune, plus l’évaluation à la recherche d’une cause secondaire doit être poussée.
L’ostéoporose idiopathique
Quand aucune cause n’est trouvée, on parle alors d’ostéoporose idiopathique. Il a été mis en évidence que cette population d’hommes ayant une ostéoporose idiopathique avait un faible niveau de remodelage osseux avec une formation osseuse réduite (14).
Évaluation du risque de fracture chez l’homme : quelles approches ?
La DMO
La définition consensuelle originale de l’OMS fixe le seuil de densitométrie de l’ostéoporose à une DMO surfacique de 2,5 écarts-types ou plus en dessous de la valeur moyenne pour les jeunes femmes en bonne santé, dérivée de la plage de référence, dite NHANES III (15). Cette approche opérationnelle a conduit à se poser la question de savoir si le seuil de densitométrie de l’ostéoporose devait être le même pour les hommes et pour les femmes.
Pour une utilisation du même seuil ?
La DMO absolue étant en moyenne plus élevée chez les hommes que chez les femmes, l’utilisation d’un même seuil et de la même plage de référence pour les deux sexes entraîne une prévalence de l’ostéoporose plus faible chez les hommes que chez les femmes. Cette approche apparaît donc comme appropriée étant donné que le risque de fracture est plus faible en moyenne chez les hommes que chez les femmes. De plus, le risque de fracture de hanche est très similaire entre les sexes pour une DMO absolue donnée (16, 17). Cette position, bien qu’adoptée par la Société internationale de densitométrie clinique en 2013, est cependant encore débattue (17, 18).
Une courbe de référence masculine ?
En France les experts du GRIO et de la Société française de rhumatologie ont établi en 2021 des recommandations qui préconisent plutôt l’utilisation d’une courbe de référence masculine que de référence féminine (19). Les deux principales raisons qui ont conduit ces experts à retenir cette position sont fondées sur le fait que l’utilisation d’une courbe de référence masculine pour établir le score permettrait de détecter un plus grand nombre de patients à risque de fracture. En effet, il a pu être montré, en utilisant les données dites NHANES III, que 6 % des hommes avaient un score inférieur à -2,5 comparé à 4 %, en utilisant les courbes NHANES des femmes, ce qui est plus consistant donc avec les données épidémiologiques fracturaires. De plus, ces mêmes experts font l’observation que, dans les essais cliniques, qui ont été développés pour montrer l’efficacité des traitements pharmacologiques de l’ostéoporose chez l’homme, des courbes masculines ont été utilisées.
Des courbes de référence masculines françaises permettant de calculer un T-score seront disponibles en 2025.
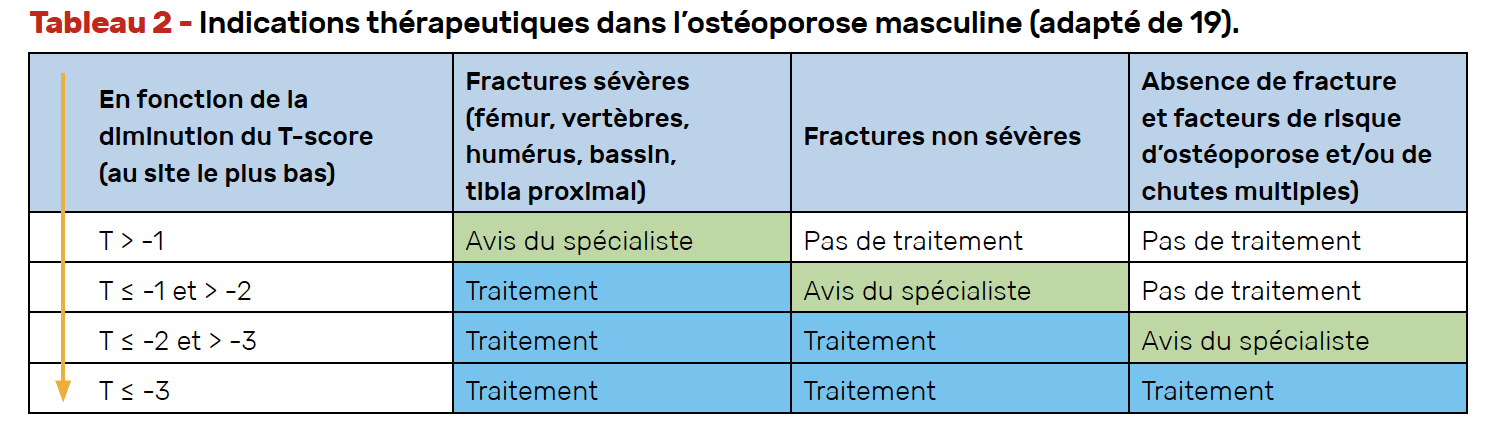
Le gradient de risque
Le gradient de risque, c’est-à-dire le rapport de risque de fracture par unité de diminution de la DMO, étant très similaire entre les femmes et les hommes, les indications à traiter l’ostéoporose masculine dépendent donc :
• du T-score le plus bas observé sur les sites du fémur ou du rachis lombaire
• et de la présence ou non d’une fracture,
• ainsi que de la sévérité de celle-ci,
comme précisé dans le tableau 2.
Le risque absolu de fracture
Bien que la DMO soit un marqueur assez spécifique d’un risque élevé de fracture, elle n’est cependant pas très sensible.
Le FRAX®
Pour une meilleure prise en compte du risque associé aux facteurs de risque autres que de la DMO, un algorithme informatique, le FRAX®, a été développé par l’OMS pour la prise en charge des maladies osseuses métaboliques (20). Cet outil utilisable en soins primaires n’est cependant utile que dans les situations où un avis spécialisé est requis comme indiqué dans le tableau 2. Cet outil, utilisable chez l’homme après 50 ans, calcule la probabilité de fracture à partir de facteurs de risque cliniques aisément accessibles chez les hommes.
Son résultat est la probabilité de fracture majeure à 10 ans (fracture de la hanche, de la colonne vertébrale, de l’humérus ou du poignet) et la probabilité de fracture de la hanche à 10 ans.
Le FRAX®plus
Un certain nombre de facteurs de risque limitant son usage auprès des spécialistes a été modifié dans une version actualisée du FRAX® disponible en ligne sous le nom de FRAX®plus (21).
• C’est ainsi que le caractère récent ou non de la fracture initiale a été pris en considération dans cette nouvelle version. En effet, des études ont bien démontré que le risque de fracture est extrêmement élevé immédiatement après une fracture dite index, mais que ce risque diminuait par la suite au cours des 2 années suivantes, sans cependant revenir au risque de base et, par la suite, augmentait avec l’âge (22). Lorsque la fracture de fragilité antérieure s’est produite au cours des 24 derniers mois, le risque excédentaire est en effet encore plus élevé. Ainsi, chez des personnes ayant subi des fractures récurrentes, 31 à 45 % d’entre elles se sont produites dans l’année suivant la première fracture, dite sentinelle, les chiffres variant selon le site fracturaire initial (23).
• L’effet des chutes sur le risque de fracture, qui n’était pas considéré dans l’outil FRAX® initial, a également été intégré dans la version FRAX®plus avec la possibilité d’ajuster la probabilité de fracture sur 10 ans, en fonction du nombre de chutes survenues au cours de l’année écoulée.
• Enfin, d’autres modificateurs de la probabilité du risque mesuré par le FRAX® comme les doses de glucocorticoïdes ou encore le score trabéculaire (TBS), mesurant la micro-architecture trabéculaire osseuse sur densitométrie, ont été également ajoutés dans cette dernière version.
Rôle du rhumatologue spécialiste de la pathologie osseuse
L’auteur de cet article pense que certaines situations cliniques justifient le recours à un praticien expert des pathologies osseuses.
• Il en est ainsi par exemple de la prise en charge des hommes jeunes chez qui surviendrait une fracture par fragilité osseuse dans un contexte inhabituel ou en cas de survenue d’une fracture sévère chez un homme ayant des T-scores rachidiens et fémoraux > -1 (19, 24).
• De même, en cas d’échec thérapeutique ou de la nécessité de prescrire un traitement après une première séquence thérapeutique, le recours au spécialiste de la pathologie osseuse est souhaitable.
• La gestion des patients ayant des contre-indications aux traitements de l’ostéoporose, en particulier en cas d’insuffisance rénale, sera également au mieux assurée par le spécialiste de la pathologie osseuse.
• Il relève aussi de ce spécialiste de discuter de la réalisation de certains paramètres de biologie comme les marqueurs du remodelage osseux. Ainsi, pour des experts du GRIO/SFR, les marqueurs de remodelage osseux ne sont pas recommandés dans le bilan d’une ostéoporose ou d’une fracture, mais peuvent être utiles lorsqu’un bisphosphate per os est prescrit pour déterminer si la suppression du remodelage osseux est insuffisante et si l’observance du traitement est satisfaisante (19, 25). Il est à noter que certains experts, considérant que des valeurs élevées des marqueurs du remodelage osseux sont associées à l’amplitude de la perte osseuse et à l’expansion périostée chez les hommes (26), les incluent dans leur algorithme de prise en charge clinique de l’ostéoporose (27).
Traitement de l’ostéoporose chez l’homme
Traitement non pharmacologique
Les mesures non pharmacologiques, telles qu’effectuer une activité physique, limiter les apports en boissons alcoolisées et arrêter le tabac, sont recommandées pour tous les hommes ostéoporotiques. Une supplémentation en vitamine D de façon à obtenir des taux sériques supérieurs à 30 ng par millilitre et à avoir des apports calciques, au mieux par l’alimentation, de 1 000 à 1 200 mg par jour sont des mesures non pharmacologiques également importantes. Enfin, si une cause secondaire d’ostéoporose est identifiée, elle doit être prise en charge.
L’activité physique
Les exercices de mise en charge, les exercices de résistance, mais aussi les approches multimodales, outre leurs bénéfices cardio-métaboliques, ont également des bienfaits sur l’appareil squelettique (28). D’autre part, un essai clinique effectué chez les hommes a démontré qu’une approche d’exercice physique comportant plusieurs composantes offrait des avantages significatifs sur la densitométrie osseuse chez les hommes d’âge moyen et plus âgés (29). En revanche, les bénéfices des interventions liées à l’exercice physique n’ont jamais pu démontrer de réduction du risque de fracture en tant que critère de jugement principal (30).
L’un des intérêts particuliers de la pratique de l’activité physique concerne la prévention des chutes. Il a été mis en évidence dans le cadre d’une revue Cochrane de la littérature effectuée en 2020 que les exercices physiques permettaient une réduction du risque de chute de 23 % (31).
L’alimentation
Outre la supplémentation calcique et vitaminique D, il est à noter qu’une alimentation équilibrée est recommandée. Ceci est d’autant plus vrai qu’à la lumière d’études récentes, les régimes végétariens et végétaliens réduisent la densité minérale osseuse de même que les restrictions caloriques (32).
Traitement pharmacologique
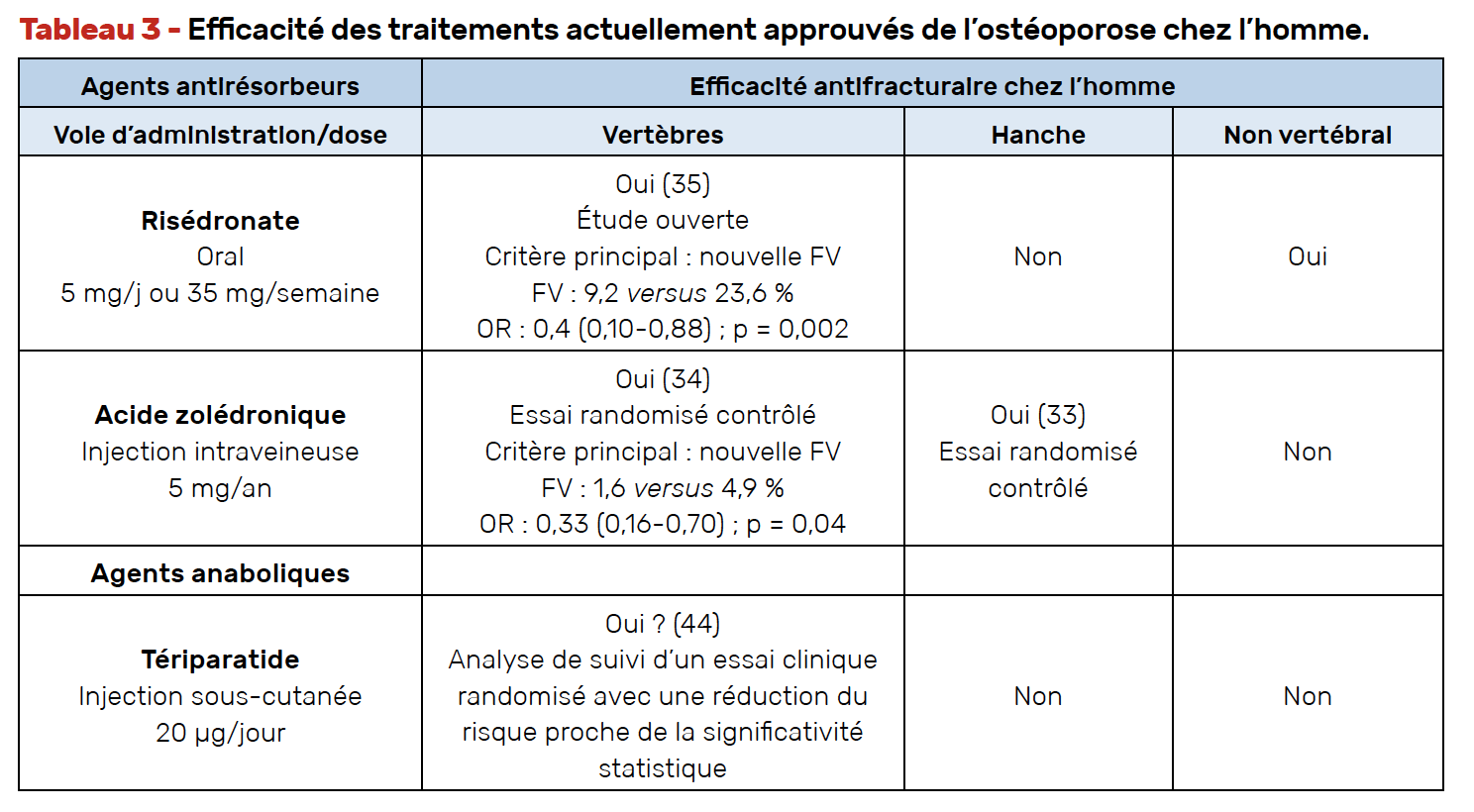
Les agents osseux actuellement approuvés dans la prise en charge thérapeutique de l’ostéoporose masculine consistent d’une part en agents antirésorbeurs et d’autre part en agents anaboliques osseux (Tab. 3).
L’acide zolédronique
Comme chez la femme, l’acide zolédronique est le traitement à privilégier en cas de polymédication, de mauvaise observance quelle qu’en soit la cause et en cas de mal-absorption. En effet, une réduction du risque de fracture de l’extrémité supérieure du fémur a été démontrée dans une étude randomisée contrôlée incluant des femmes, mais aussi des hommes (33). De plus, une étude ouverte menée spécifiquement chez l’homme a mis en évidence une réduction du risque de fracture vertébrale (34).
Le risédronate
Une étude chez l’homme menée sur 2 ans dans laquelle le risédronate augmentait significativement la DMO aux trois sites a montré une réduction de 60 % du risque de fracture vertébrale, le traitement prévenant également le risque de fracture non vertébrale (35).
L’alendronate
L’alendronate, bien que prescrit, n’est pas remboursé en France. Seule une méta-analyse d’essais randomisés montre une réduction du risque de fracture vertébrale chez l’homme (36). On rappelle que, dans l’ostéoporose masculine, dans les études alendronate, dont l’objectif principal était le gain densitométrique à 2 ans, les risques de fracture vertébrale et de fracture non vertébrale n’étaient pas significativement réduits respectivement OR : 0,35 (0,10-1,24) et OR : 0,77 (0,23-2,60) (37, 38).
Le dénosumab
Deux essais cliniques randomisés incluant respectivement 242 et 47 hommes ostéoporotiques suivis pendant 2 ans et traités par dénosumab ou placebo ont montré des variations de DMO significativement plus élevées avec le dénosumab qu’avec le placebo sur les sites mesurés (39, 40). L’ étude japonaise menée chez 47 hommes ostéo-porotiques relevait une incidence de nouvelles fractures vertébrales chez 8,3 % dans le groupe placebo contre aucune dans le groupe traité par dénosumab, mais la différence n’était pas statistiquement significative (p = 0,15) (40).
Le tériparatide
Quant au tériparatide, il peut être prescrit en première intention chez les hommes avec au moins deux fractures vertébrales pour être remboursable. Dans une étude de suivi de 18 mois après l’arrêt du traitement par tériparatide chez 437 hommes ayant une faible DMO et bien que la majorité d’entre eux n’ait pas eu de séquence thérapeutique avec un antirésorbeur, ceux qui avaient reçu le traitement par tériparatide avaient une incidence 83 % plus faible de fractures vertébrales que dans le groupe placebo (p < 0,01) (41).
L’abaloparatide
Une méta-analyse de deux études effectuées chez l’homme avec l’abaloparatide a mis en évidence des gains significatifs versus placebo au rachis lombaire, au col du fémur et à la hanche totale (42).
Le romosozumab
Quant au romosozumab, son utilisation chez l’homme (n = 245) dans un essai randomisé versus placebo n’a pu conclure que sur son efficacité densitométrique (43).
L’homme en situation d’hypogonadisme
Avec l’âge, la disponibilité de la testostérone libre diminue. Il en est ainsi du fait de la réduction de la production des stéroïdes sexuels, mais aussi de l’augmentation de la SHBG (globuline liant les hormones sexuelles) (44). En fait, c’est l’estradiol (issu de l’aromatisation de la testostérone) qui tient le rôle principal dans l’homéostasie osseuse chez l’homme en agissant sur les ostéoblastes, les ostéocytes et les ostéoclastes (45). Chez l’homme âgé, la plupart des données suggèrent le rôle d’un taux faible d’estradiolémie dans l’augmentation de la perte osseuse et du risque de fracture (46).
Le traitement de substitution de la testostérone
Un bénéfice par traitement de substitution de la testostérone n’a été observé dans une méta-analyse qu’en termes de DMO au rachis lombaire et uniquement chez les hommes hypogonadiques (47). Dans une étude récente randomisée en double aveugle et contrôlée par placebo, une évaluation de la réduction du risque de fracture clinique a été mise en œuvre dans le cadre d’un essai principal qui évaluait la sécurité cardiovasculaire du traitement par la testostérone chez des hommes d’âge moyen et plus âgés souffrant d’hypogonadisme. Dans cette étude qui a inclus 5 200 participants et après un suivi de 3,2 ans, une fracture clinique est survenue chez 3,5 % du groupe traité par de la testostérone en gel et chez 2,46 % du groupe placebo. Le hazard ratio était de 1,43 (IC 95 % : 1,4-1,97) (48). Il apparaît donc que l’incidence des fractures semble numériquement plus élevée dans le groupe testostérone.
Bien qu’il existe des limites à cette étude sur le plan méthodologique. (49, 50), ces résultats ne bouleversent pas les recommandations françaises de prise en charge de l’ostéoporose masculine, à savoir de ne pas complémenter les patients hypogonadiques par testostérone avec pour finalité la réduction du risque de fracture (19).
Conclusion
Bien qu’étant fréquente, l’ostéoporose masculine reste une pathologie négligée par le corps médical, moins de 20 % des hommes ostéoporotiques y compris quand ils ont des fractures sévères sont traités. La prise en considération des préférences des patients est indispensable car l’adhésion des hommes n’est pas meilleure que celle observée chez les femmes (64 % des hommes traités par bisphosphonates ne prennent plus leur traitement à 1 an) (51). Cela souligne l’importance de l’éducation thérapeutique du suivi des patients.
L’auteur déclare ne pas avoir de liens d’intérêt en rapport avec cet article.
Bibliographie
1. Lespessailles É. De plus en plus de patients et une prise en charge très insuffisante. Rev Prat 2020 ; 70.
2. Guggenbuhl P. Osteoporosis in males and females: Is there really a difference? Joint Bone Spine 2009 ; 76 : 595‑601.
3. Gullberg B, Johnell O, Kanis JA. World-wide projections for hip fracture. Osteoporos Int 1997 ; 7 : 407‑13.
4. Briot K, Maravic M, Roux C. Changes in number and incidence of hip fractures over 12 years in France. Bone 2015 ; 81 : 131‑7.
5. O’Neill TW, Felsenberg D, Varlow J et al. The prevalence of vertebral deformity in European men and women: The european vertebral osteoporosis study. J Bone Miner Res 1996 ; 11 : 1010‑8.
6. Jiang HX, Majumdar SR, Dick DA et al. Development and initial validation of a risk score for predicting in-hospital and 1-year mortality in patients with hip fractures. J Bone Miner Res 2005 ; 20 : 494‑500.
7. Katsoulis M, Benetou V, Karapetyan T et al. Excess mortality after hip fracture in elderly persons from Europe and the USA: the CHANCES project. J Intern Med 2017 ; 281 : 300‑10.
8. Center JR, Nguyen TV, Sambrook PN, Eisman JA. Hormonal and biochemical parameters in the determination of osteoporosis in elderly men. J Clin Endocrinol Metab 1999 ; 84 : 3626‑35.
9. Dent E, Morley JE, Cruz-Jentoft AJ et al. Physical frailty: ICFSR international clinical practice guidelines for identification and management. J Nutr Health Aging 2019 ; 23 : 771‑87.
10. Rinonapoli G, Ruggiero C, Meccariello L et al. Osteoporosis in men: a review of an underestimated bone condition. Int J Mol Sci 2021 ; 22 : 2105.
11. Jauffret C, Périchon R, Lamer A et al. Association between sarcopenia and fracture risk in a population from the UK biobank database. J Bone Miner Res 2023 ; 38 : 1422‑34.
12. Diab DL, Watts NB. Updates on osteoporosis in men. Endocrinol Metab Clin North Am 2021 ; 50 : 239‑49.
13. Fink HA, Litwack-Harrison S, Taylor BC et al. Clinical utility of routine laboratory testing to identify possible secondary causes in older men with osteoporosis: the Osteoporotic Fractures in Men (MrOS) Study. Osteoporos Int 2016 ; 27 : 331‑8.
14. Khosla S. Idiopathic osteoporosis-is the osteoblast to blame? J Clin Endocrinol Metab 1997 ; 82 : 2792‑4.
15. Assessment of fracture risk and its application to screening for postmenopausal osteoporosis. Report of a WHO Study Group. World Health Organ Tech Rep Ser 1994 ; 843 : 1‑129.
16. De Laet CE, Van Hout BA, Burger H et al. Hip fracture prediction in elderly men and women: validation in the Rotterdam study. J Bone Miner Res 1998 ; 13 : 1587‑93.
17. Binkley N, Adler R, Bilezikian JP. Osteoporosis diagnosis in men: the T-score controversy revisited. Curr Osteoporos Rep 2014 ; 12 : 403‑9.
18. Kanis JA, Bianchi G, Bilezikian JP et al. Towards a diagnostic and therapeutic consensus in male osteoporosis. Osteoporos Int 2011 ; 22 : 2789‑98.
19. Bouvard B, Briot K, Legrand E et al. Recommandations françaises de la prise en charge et du traitement de l’ostéoporose masculine. Rev Rhum 2021 ; 88 : 173‑82.
20. Kanis JA, Oden A, Johnell O et al. The use of clinical risk factors enhances the performance of BMD in the prediction of hip and osteoporotic fractures in men and women. Osteoporos Int 2007 ; 18 : 1033‑46.
21. Schini M, Johansson H, Harvey NC et al. An overview of the use of the fracture risk assessment tool (FRAX) in osteoporosis. J Endocrinol Invest 2024 ; 47 : 501‑11.
22. Ahmed LA, Center JR, Bjørnerem A et al. Progressively increasing fracture risk with advancing age after initial incident fragility fracture: the Tromsø study. J Bone Miner Res 2013 ; 28 : 2214‑21.
23. Kanis JA, Johansson H, Odén A et al. Characteristics of recurrent fractures. Osteoporos Int 2018 ; 29 : 1747‑57.
24. Lespessailles E, Cortet B, Legrand E et al. Low-trauma fractures without osteoporosis. Osteoporos Int 2017 ; 28 : 1771‑8.
25. Diez-Perez A, Naylor KE, Abrahamsen B et al. International Osteoporosis Foundation and European Calcified Tissue Society Working Group. Recommendations for the screening of adherence to oral bisphosphonates. Osteoporos Int 2017 ; 28 : 767‑74.
26. Marques EA, Gudnason V, Lang T et al. Association of bone turnover markers with volumetric bone loss, periosteal apposition, and fracture risk in older men and women: the AGES-Reykjavik longitudinal study. Osteoporos Int 2016 ; 27 : 3485‑94.
27. Lorentzon M, Branco J, Brandi ML et al. Algorithm for the use of biochemical markers of bone turnover in the diagnosis, assessment and follow-up of treatment for osteoporosis. Adv Ther 2019 ; 36 : 2811‑24.
28. Daly RM, Dalla Via J, Duckham RL et al. Exercise for the prevention of osteoporosis in postmenopausal women: an evidence-based guide to the optimal prescription. Braz J Phys Ther 2019 ; 23 : 170‑80.
29. Daly RM, Dalla Via J, Fyfe JJ et al. Effects of exercise frequency and training volume on bone changes following a multi-component exercise intervention in middle aged and older men: Secondary analysis of an 18-month randomized controlled trial. Bone 2021 ; 148 : 115944.
30. Lamb SE, Bruce J, Hossain A et al. Screening and intervention to prevent falls and fractures in older people. N Engl J Med 2020 ; 383 : 1848‑59.
31. Sherrington C, Fairhall N, Kwok W et al. Evidence on physical activity and falls prevention for people aged 65+ years: systematic review to inform the WHO guidelines on physical activity and sedentary behaviour. Int J Behav Nutr Phys Act 2020 ; 17 : 144.
32. Veronese N, Reginster JY. The effects of calorie restriction, intermittent fasting and vegetarian diets on bone health. Aging Clin Exp Res 2019 ; 31 : 753‑8.
33. Lyles KW, Colón-Emeric CS, Magaziner JS et al. Zoledronic acid and clinical fractures and mortality after hip fracture. N Engl J Med 2007 ; 357 : 1799‑809.
34. Boonen S, Reginster JY, Kaufman JM et al. Fracture risk and zoledronic acid therapy in men with osteoporosis. N Engl J Med 2012 ; 367 : 1714‑23.
35. Ringe JD, Farahmand P, Faber H, Dorst A. Sustained efficacy of risedronate in men with primary and secondary osteoporosis: results of a 2-year study. Rheumatol Int 2009 ; 29 : 311‑5.
36. Sawka AM, Papaioannou A, Adachi JD et al. Does alendronate reduce the risk of fracture in men? A meta-analysis incorporating prior knowledge of anti-fracture efficacy in women. BMC Musculoskelet Disord 2005 ; 6 : 39.
37. Orwoll E, Ettinger M, Weiss S et al. Alendronate for the treatment of osteoporosis in men. N Engl J Med 2000 ; 343 : 604‑10.
38. Ringe JD, Dorst A, Faber H, Ibach K. Alendronate treatment of established primary osteoporosis in men: 3-year results of a prospective, comparative, two-arm study. Rheumatol Int 2004 ; 24 : 110‑3.
39. Orwoll E, Teglbjærg CS, Langdahl BL et al. A randomized, placebo-controlled study of the effects of denosumab for the treatment of men with low bone mineral density. J Clin Endocrinol Metab 2012 ; 97 : 3161‑9.
40. Nakamura T, Matsumoto T, Sugimoto T et al. Clinical Trials Express: fracture risk reduction with denosumab in Japanese postmenopausal women and men with osteoporosis: denosumab fracture intervention randomized placebo controlled trial (DIRECT). J Clin Endocrinol Metab 2014 ; 99 : 2599‑607.
41. Kaufman JM, Orwoll E, Goemaere S et al. Teriparatide effects on vertebral fractures and bone mineral density in men with osteoporosis: treatment and discontinuation of therapy. Osteoporos Int 2005 ; 16 : 510‑6.
42. Beaudart C, Demonceau C, Sabico S et al. Efficacy of osteoporosis pharmacological treatments in men: a systematic review and meta-analysis. Aging Clin Exp Res 2023 ; 35 : 1789‑806.
43. Lewiecki EM, Blicharski T, Goemaere S et al. A phase III randomized placebo-controlled trial to evaluate efficacy and safety of romosozumab in men with osteoporosis. J Clin Endocrinol Metab 2018 ; 103 : 3183‑93.
44. Kaufman JM. Diagnosis of hypogonadism in ageing men. Rev Endocr Metab Disord 2022 ; 23 : 1139‑50.
45. Finkelstein JS, Lee H, Leder BZ et al. Gonadal steroid-dependent effects on bone turnover and bone mineral density in men. J Clin Invest 2016 ; 126 : 1114‑25.
46. Meier C, Nguyen TV, Handelsman DJ et al. Endogenous sex hormones and incident fracture risk in older men: the Dubbo Osteoporosis Epidemiology Study. Arch Intern Med 2008 ; 168 : 47‑54.
47. Corona G, Vena W, Pizzocaro A et al. Testosterone supplementation and bone parameters: a systematic review and meta-analysis study. J Endocrinol Invest 2022 ; 45 : 911‑26.
48. Snyder PJ, Bauer DC, Ellenberg SS et al. Testosterone treatment and fractures in men with hypogonadism. N Engl J Med 2024 ; 390 : 203‑11.
49. Grossmann M, Anawalt BD. Breaking News – Testosterone treatment and fractures in older men. N Engl J Med 2024 ; 390 : 267‑8.
50. Kovac E, Weiss RE, Arap W. Testosterone treatment and fractures in men with hypogonadism. N Engl J Med 2024 ; 390 : 1342‑3.
51. Mikyas Y, Agodoa I, Yurgin N. A systematic review of osteoporosis medication adherence and osteoporosis-related fracture costs in men. Appl Health Econ Health Policy 2014 ; 12 : 267‑77.




