Ayant été incités depuis 30 ans à utiliser surtout des scores composites (DAS28, BASDAI, HAQ, WOMAC, DASH, OSWESTRY, etc.) pour mesurer l’activité des arthrites, enthésites, arthroses, tendinoses, ou lombalgies chroniques, certains rhumatologues peuvent avoir en partie refoulé que le motif essentiel de consultation en rhumatologie reste la persistance de douleurs chroniques.
Contexte
L’introduction précoce des traitements de fond et des biomédicaments n’empêche assez souvent pas l’installation de douleurs chroniques
Une des raisons de l’inconfort des rhumatologues à évaluer, sur le seul niveau de douleurs résiduelles des patients, l’efficacité de leurs interventions est l’observation fréquente, dans les rhumatismes inflammatoires, malgré l’introduction précoce des meilleurs traitements de fond et/ou biomédicaments, la persistance, voire, dans un petit nombre de cas, la majoration, de douleurs articulaires ou enthésitiques, y compris quand ont disparu sous traitement tout signe d’inflammation clinique ou biologique. De telles douleurs résiduelles peuvent concerner des personnes qui ne valident pourtant ni les critères de fibromyalgies (douleurs neuropathiques/neuroplastiques “centrales”), ni ceux des syndromes des petites fibres (douleurs neuropathiques “périphériques”).
Ces douleurs pourraient résulter, au moins en partie, d’une néo-innervation excessive des articulations et/ou enthèses induite par le rhumatisme inflammatoire. Ceci vaut chez les patients ayant développé tôt des lésions structurales, car ces phénomènes de néo-innervations concernent particulièrement l’os sous-chondral. Toutefois, ces phénomènes de néo-innervations trop pérennes pourraient aussi concerner des patients sans lésions structurales, et toucher non seulement l’os et les enthèses, mais aussi les synoviales (1), en particulier si celles-ci libèrent beaucoup la chémokine CCL2 (2). Une même dissociation entre la disparition de tout signe biologique ou radiologique d’inflammation, mais la persistance de douleurs très chroniques, vaut encore plus pour les douleurs tendineuses ou discales.
La création des services d’algologie n’a pas fait disparaître les douleurs chroniques, dont la plupart gardent une part “nociceptive” prépondérante
Même si la création des services d’algologie a rendu de grands services (ne serait-ce qu’en déchargeant les rhumatologues de beaucoup de patients dont les douleurs sont surtout d’origine centrale), ils sont loin d’avoir répondu à toutes les attentes des patients insuffisamment soulagés par les rhumatologues de leurs douleurs périphériques, y compris dans le contexte des lombalgies, arthroses, tendinoses, et rhumatismes inflammatoires chroniques. L’efficacité des opiacés de classe II ou III y reste, par exemple, très faible, et ces drogues peuvent même aggraver certaines de ces pathologies :
• en induisant des hyperalgésies avec hyperpathies paradoxales (3)
• et en augmentant la perméabilité de l’intestin (4) à divers métabolites toxiques d’un microbiote qu’elles altèrent par ailleurs (5) (ces métabolites bactériens pouvant contribuer à la pathogénie des arthroses et rhumatismes inflammatoires, en modifiant le métabolisme de certains cartilages (6), ou l’épigénétique des synoviocytes et lymphocytes (7, 8)).
Les douleurs neuropathiques/neuroplastiques sont initiées, et parfois entretenues, par une néo-innervation des tissus douloureux non visible en imagerie
La bien plus faible réponse qu’espérée aux antalgiques, l’efficacité souvent insuffisante des anti-inflammatoires, et l’absence de parallélisme usuel entre lésions structurales et intensité des douleurs avaient conduit à mettre en avant, comme explication principale à ces phénomènes, les concepts de douleurs neuropathiques (modifications épigénétiques au sein des premiers, mais aussi seconds et troisième neurones), et/ou neuroplastiques (créations dans la moelle épinière, voire le cerveau, de nouvelles synapses inter-neuronales, avec ou sans modification du réseau d’astrocytes qui modulent les échanges entre neurones).
Même si une part de douleurs neuropathiques ou neuroplastiques est, de fait, souvent retrouvée en cas de douleurs chroniques, leur induction résulte d’une activation initiale de fibres nociceptives au sein des tissus. Le fait qu’une néo-innervation anormale y perdure à bas bruit, séquellaire d’une lésion ou agression immune/toxique passée, pourrait aussi ensuite entretenir ces douleurs neuropathiques/neuroplastiques, même lorsque l’imagerie reste, depuis le départ, normale.
L’imagerie a pu profondément fausser le raisonnement de beaucoup de médecins, voire chercheurs
Les scanners (années 1980), puis IRM et échographies (années 1990) ont autant fasciné les médecins que les non-médecins, en raison de leur capacité à visualiser des anomalies que les clichés standard ne montraient pas, en particulier dans les parties molles. Ceci a eu le grand avantage de pousser les cliniciens à savoir lire, voire réaliser (échographie), ces examens, aussi bien, voire mieux, que la plupart des radiologues (comme antérieurement pour la lecture des radiographies standard). Cet engouement pour l’imagerie a toutefois eu quatre effets pervers majeurs.
Perte d’intérêt pour l’examen clinique
Voire dénigrement de celui-ci, par manque de temps, et/ou par complexes en sens opposés du médecin-clinicien : complexe d’infériorité vis-à-vis des radiologues, faisant délaisser aux rhumatologues leur perfectionnement en examen clinique pour consacrer tout leur apprentissage post-universitaire à l’imagerie ; complexe de supériorité vis-à-vis des kinésithérapeutes/ostéopathes, qui connaissent désormais parfois mieux les nouveautés en examen clinique que les rhumatologues (ce qui peut pousser encore plus les rhumatologues à faire plus/trop confiance à l’imagerie, au prétexte que leurs prescriptions et réinterprétations d’imagerie restent encore des prérogatives médicales).
Sacralisation de l’imagerie sur un mode binaire
Au point d’en faire, de manière absurde, un “gold-standard”, comme si on devait soigner des images, ceci aboutissant encore plus à dénigrer la clinique, alors qu’elle est souvent plus pertinente que l’imagerie, cette dernière étant en effet dans les pathologies rhumatologiques source de beaucoup de faux positifs, comme de faux négatifs.
Remise en cause de l’organicité
Incitation, en cas de négativité de l’imagerie, à remettre en cause l’organicité des douleurs des patients, et/ou à invoquer seulement des mécanismes “neuropathiques” ou “neuroplastiques”, comme si ceux-ci survenaient sans lésion tissulaire initiale (« c’est dans votre tête »).
Méconnaissance de l’origine de la douleur
Perte de la notion, pourtant élémentaire, que les douleurs émanent d’abord de tout petits nerfs (fibres C, et I-A-delta) et que ceux-ci sont plus fins qu’un cheveu, sans traduction en ENMG, et invisibles en imagerie (un dentiste ne sollicite pas une IRM des dents pour savoir qu’une d’entre elles fait mal, d’autant que cette IRM serait incapable de montrer quel nerf dentaire est à l’origine de la douleur).
Le sprouting
La plupart des douleurs chroniques de l’appareil locomoteur pourraient être dues à des néo-innervations,
invisibles en imagerie
Il a été montré, il y a bientôt 30 ans déjà, que les patients ayant souffert, de leur vivant, de lombalgies chroniques avaient, à l’autopsie, des disques non seulement dégénérés (mais guère plus que les contrôles), mais surtout (et à la différence des personnes non lombalgiques), sièges d’une néo-innervation pathologique. Celle-ci est le fait de fibres nociceptives et/ou sympathiques, gagnant la profondeur de l’annulus, et souvent le nucleus (9). Chez les non-lombalgiques ces structures ne contiennent pas de terminaisons nerveuses, lesquelles sont alors restreintes à la partie superficielle de l’annulus. Ces observations ont été répliquées à de nombreuses reprises (9, 10).
Des constatations similaires ont été faites ensuite dans les pathologies dégénératives des tendons (tendinoses) (11), comme des articulations (arthroses) (12, 13), et tant chez l’homme que dans divers modèles expérimentaux.
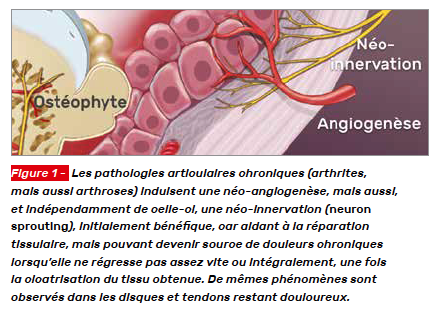
Ces néo-innervations (nerve sprouting) (Fig. 1), plus ou moins durables selon les personnes, expliquent sans doute, en bonne part, la chronicité des douleurs chez certains patients et les discordances radiocliniques. Par exemple, dans l’arthrose, la corrélation entre les douleurs et les œdèmes sous-chondraux n’est bonne qu’au tout début des poussées, et elle devient faible ensuite (2).
Différentes études ont par ailleurs montré que la rémanence de ces fibres nerveuses nociceptives et/ou sympathiques (dans des zones de l’organisme où elles ne sont normalement peu ou pas présentes) ne nécessitait pas la persistance d’une inflammation chronique.
Ces travaux ont une importance capitale pour le rhumatologue, car :
• ils expliquent la chronicité de certaines douleurs chroniques, sans avoir à invoquer des douleurs neuropathiques ou neuroplastiques (même si ces néo-innervations peuvent aussi les favoriser/entretenir) ;
• ils rappellent que l’inflammation n’est qu’un des co-facteurs inducteurs de douleurs (conjointement avec l’anoxie-acidose, et la lyse cellulaire avec libération de potassium et d’ATP) ;
• ils soulignent que les “tendinites” ne sont le plus souvent pas dues à une inflammation chronique, mais à une néo-innervation pathologique par sa durée au sein de fibres lésées (si bien qu’il ne faudrait plus utiliser que le terme de “tendinose”) ;
• surtout, ils ont ouvert un très vaste champ de recherches sur les mécanismes d’intrusion puis de persistance de néo-innervations nociceptives dans les tissus. Ceci pourrait déboucher (enfin !) sur des traitements préventifs ou curatifs plus efficaces des douleurs chroniques de l’appareil locomoteur (lombalgies, arthroses, tendinoses, douleurs des arthrites chroniques) que les seuls antalgiques et anti-inflammatoires, ou essais de traitements par radio-fréquence, ainsi que sur la mise au point de traitements des algodystrophies et ostéo-arthropathies nerveuses.
Les limites du blocage du NGF ne doivent pas désintéresser du sujet des néo-innervations excessives
Des recherches cliniques fondées sur ce concept ont déjà été menées depuis 20 ans, en particulier des travaux testant l’efficacité d’un inhibiteur du NGF (nerve growth factor) (le tanézumab : anti-NGF) dans les arthroses (du genou surtout) (14, 15), puis les lombalgies (16).
Le nerve growth factor
Le NGF a été la première cible choisie car :
• les mutations inactivatrices du NGF (insensibilité à la douleur de type V) ou de son récepteur (type IV) sont (avec les mutations du gène SCN9A codant pour le canal sodium Nav1.7) parmi les principales étiologies d’insensibilité congénitale à la douleur (17), source d’hypo-algésie des membres et des viscères contrastant avec la préservation des sens tactiles et protopathiques ;
• le NGF est, comme son nom l’indique, surtout un facteur de croissance des neurones, facilitant le processus de néo-innervation (par “sprouting” des terminaisons nerveuses), même si sa libération peut aussi contribuer à majorer la part neuropathique des douleurs en modifiant l’épigénétique des premiers ou seconds neurones de la moelle épinière (18, 19) ;
• le NGF a aussi des propriétés pro-inflammatoires, notamment en activant les monocytes (Fig. 2) (17, 19) ;
• le NGF est libéré en cas de lésion des nerfs, au moins après traumatismes ou section de ceux-ci, mais il peut aussi l’être par certaines cellules gliales (cellules dites satellites du ganglion spinal) entourant les noyaux des neurones, à condition que le pro-NGF fabriqué par ces cellules gliales se lie à une autre molécule fabriquée par ces mêmes cellules gliales (la sortiline) pour pouvoir être alors clivé en NGF (20) ;
• le NGF peut enfin, et surtout, être produit et relâché par diverses cellules de tissus lésés de l’appareil locomoteur, dont les mastocytes, et les chondrocytes de l’os sous-chondral ou du disque (qui synthétisent aussi du BDNF et du GDNF) (21).
Anti-NGF
Une étude princeps avait confirmé le bien fondé du concept de blocage du NGF, puisque à fortes doses (200 microgrammes par kg) le tanézumab avait démontré une efficacité encore jamais égalée sur les douleurs de gonarthrose (14) : baisse de 4,35 points (sur 10) des douleurs à la marche, versus seulement 1,6 point dans le groupe placebo. Il a, hélas, été ensuite noté une toxicité du tanézumab (lésions comparables à des ostéonécroses sous-chondrales) aux doses permettant une réduction marquée des douleurs chroniques de gonarthrose. Ceci a trop grevé ses rapports bénéfices/risques et bénéfices/coût pour permettre sa commercialisation, d’autant qu’à des doses plus tolérables, l’efficacité du tanézumab n’est en moyenne pas supérieure à celle des anti-inflammatoires non stéroïdiens (AINS), malgré un coût bien plus élevé.
Autres cibles
Ce demi-échec ne doit toutefois pas décourager de persévérer dans la recherche d’autres façons de réduire, par des moyens pharmacologiques systémiques ou locaux, les néo-innervations excessives ou trop durables dans divers tissus de l’appareil locomoteur. Il existe par exemple bien d’autres cibles à inhiber que le NGF, notamment d’autres neurotrophines (GDNF : glial derived nerve factor ; BDNF : brain derived nerve factor ; NT3 : neurotrophine 3), et diverses molécules à effet “chémo-attractant” pour les fibres sensitives (voir infra).
Il pourrait être également intéressant de cibler les récepteurs aux neurotrophines. En effet, autant qu’une libération excessive de certaines neurotrophines, c’est une surexpression, sur certaines cellules des tissus lésés de leurs récepteurs (comme TrkA, le récepteur du NGF), qui pourrait être un phénomène-clé dans l’induction du “sprouting”, car permettant l’amarrage des bourgeons de terminaisons nerveuses dans les tissus et leur survie.
Ont par ailleurs été découvertes des molécules au contraire répulsives pour la croissance nerveuse qui pourraient être d’encore meilleurs outils thérapeutiques.
Une meilleure connaissance des mécanismes intimes faisant qu’une néo-innervation s’installe puis persiste, et chez certaines personnes surtout, pourrait donc avoir des retombées thérapeutiques très importantes, y compris dans le contexte des métastases osseuses où un sprouting pathologique survient aussi.
L’inflammation n’est pas la seule explication à la néo-innervation, et l’usage de corticoïdes locaux peut avoir des effets délétères, voire contre-productifs sur les douleurs à long terme
Il était convenu, il y a 30 à 40 ans, qu’une douleur puisse provenir d’un tissu normalement non ou peu innervé (comme un tendon ou le disque intervertébral) du fait de la survenue d’une inflammation induite par des micro-lésions de ce tissu. Cette inflammation était présumée pouvoir, ensuite, diffuser assez à la périphérie des tendons/disques/articulations pour que des signaux chimiques (prostaglandines, cytokines, etc.) viennent sensibiliser les nerfs naturellement présents au pourtour de ces tissus (péri-tendon, partie périphérique de l’annulus, ou face profonde des capsules articulaires).
Ceci reste souvent vrai pour les douleurs aiguës, rapidement résolutives, mais n’explique pas la rémanence des douleurs chroniques des tendons, disques et os sous-chondraux à distance de la phase inflammatoire initiale, ni leur résistance usuelle aux anti-inflammatoires.
C’est en fait la présence ou persistance d’un excès de néo-innervation qui pourrait bien être le phénomène essentiel, et celle-ci ne semble que partiellement et inconstamment inhibée par l’utilisation précoce d’anti-inflammatoire, et/ou l’usage de corticoïdes locaux.
Les infiltrations de corticoïdes ont, par ailleurs, pour limite leur toxicité générale et locale, voire des effets contre-productifs à long terme. Il n’est en effet pas toujours bienvenu de bloquer l’inflammation survenant dans les premiers moments d’une lésion de l’appareil locomoteur (risque de rupture différée des tendons, ou de moins bonne réparation des lésions cartilagineuses après infiltrations de corticostéroïdes, voire de majoration différée des douleurs).
Les moins bonnes cicatrisations des tendons ou du cartilage après infiltrations de corticostéroïdes (surtout si elles sont répétées) avaient d’abord été mises sur le compte d’un effet toxique direct de trop fortes concentrations de corticoïdes sur les cellules des tissus infiltrés (ténocytes (22), chondrocytes (23), ostéocytes (24)). En fait, il apparaît de plus en plus plausible que deux autres phénomènes y contribuent :
• l’inhibition de la migration de cellules souches réparatrices à partir des bourses de voisinage (qui sont des réservoirs de cellules souches) (25) ;
• l’inhibition trop précoce du phénomène de sprouting nerveux physiologique jusqu’à la zone de lésion, même si ceci n’a été que très peu étudié (26). En effet, à la phase aiguë, l’inflammation favorise aussi (notamment via la libération d’IL-1 (27)) ce sprouting qui, lorsqu’il n’est que transitoire et modéré, a alors des effets bénéfiques, car il permet d’apporter/déverser dans les tissus néo-innervés :
- différents agents vaso-actifs comme le CGRP et la substance P en provenance des néo-terminaisons nerveuses des fibres peptidergiques (qui, en ouvrant les micro-vaisseaux, aident à déblayer les “gravats” du chantier en cours) ;
- des facteurs de croissance nerveux (neurotrophines, dont le NGF, BDNF, GDNF etc.) aussi libérés de manière autocrine par certains nerfs, en plus de leur synthèse paracrine par diverses cellules des tissus (Fig. 2). En effet, ces neurotrophines sont aussi des facteurs de croissance pour les ténocytes/chondrocytes/cellules discales, tout en ayant parfois (BDNF) la capacité de faciliter conjointement une néo-angiogenèse contribuant à la cicatrisation.
Il paraît donc essentiel de bien disséquer :
• la nature des fibres nerveuses ou molécules à l’origine des effets trophiques et algogènes de la néo-innervation, tant à la phase aiguë (aspect favorable de la néo-innervation), que tardif (aspect pathologique de la néo-innervation quand elle perdure après la phase de cicatrisation) ;
• les facteurs attirant (phase aiguë), ou au contraire refoulant (retour à la normale à la phase tardive, dans des délais variables selon les individus), cette néo-innervation.
Repérer quels signaux (ou absence de molécules répulsives) en provenance des tissus incitent la néo-innervation à y persister une fois le tissu en apparence cicatrisé pourrait permettre des avancées thérapeutiques majeures en rhumatologie. Il pourrait en effet devenir possible de faire régresser plus vite cette néo-innervation, passée la phase aiguë où elle est bénéfique, sous réserve que ces procédés ne nuisent pas, tant à la trophicité présente du tissu qu’à sa capacité ultérieure à se réparer en cas de nouvelle lésion.
Les nerfs ne sont pas que des câbles électriques, mais aussi des autoroutes à double sens pour de nombreux neuromédiateurs
Les nerfs sensitifs ne sont pas seulement des “câbles électriques” chargés de transmettre un signal de danger au cerveau, sous forme d’une vague de dépolarisation déclenchée en distalité, ils véhiculent aussi des signaux chimiques, bien plus lents, mais tout aussi importants. Ceci est encore plus vrai pour les petites fibres nociceptives C et A-delta, amyélinisées, dont la dépolarisation est lente, et les signaux électriques trop faibles pour pouvoir être captés en électrophysiologie traditionnelle.
Ces messages chimiques véhiculés par les fibres nerveuses sensitives ne se déplacent par ailleurs pas de manière unidirectionnelle, et seulement de la périphérie vers le noyau du premier axone (situé dans le ganglion spinal). En effet, les fibres nerveuses sont des “autoroutes à double sens”, et diverses molécules, synthétisées au sein du neurone, descendent au contraire du noyau vers la partie distale (tissulaire) de l’axone, pour pouvoir y être éventuellement libérées en périphérie dans les tissus. Ceci est par exemple le cas physiologiquement dans les réflexes d’axones, comme la raie vaso-motrice cutanée. Ces réflexes d’axone résultent de l’activation des canaux ioniques TRPV-1 des fibres peptidergiques de la peau (petites fibres C synthétisant beaucoup de substance P et de CGRP) (ces canaux ioniques étant également présents à la surface des cellules dendritiques et mastocytes) (Fig. 2). En résultent :
• une synthèse et libération accrue par la distalité des nerfs de protéine HMGB1 (high mobility group box 1) (28), substance P et CGRP (qui vont induire la vasodilatation de la raie vaso-motrice) (phénomène inhibé par les barbituriques utilisés en anesthésie chirurgicale, car ils bloquent aussi les canaux TRPV-1) (29) ;
• la pré-activation des cellules dendritiques, monocytes et mastocytes à faire face à un éventuel danger (avec synthèse, voire sécrétion accrue de diverses cytokines) (30).
Ces réflexes d’axones sont l’exemple le plus connu des inflammations neurogènes, lesquelles jouent un rôle lors des premières phases des rhumatismes inflammatoires chroniques, en amplifiant les synovites, via la vasodilatation et la pré-activation des cellules de l’immunité innée. Les réflexes d’axones peuvent être accrus par la libération dans les tissus de la chémokine CCL-2, car elle sensibilise les noyaux des premiers neurones sensitifs dans le ganglion spinal, en s’y liant avec le récepteur CCR2. Ceci favorise une synthèse encore plus grande dans le ganglion spinal de substance P, laquelle va ensuite pouvoir être relâchée en plus grande quantité en périphérie de l’axone pour entretenir l’inflammation neurogène (31).
Il faut toutefois souligner que le rôle des nerfs sur la réponse inflammatoire tissulaire peut beaucoup varier selon le type de nerfs étudiés, et selon la nature des tissus innervés : certaines fibres nerveuses, dont celles détruites par la capsaïcine, ont par exemple, et à l’inverse, plutôt un rôle de prévention de la survenue d’une inflammation neurogène excessive dans les articulations. Leur destruction entraîne en effet une réponse inflammatoire encore plus aiguë aux stades initiaux des modèles animaux d’arthrite (32), ce qui est une des raisons pour lesquelles la capsaïcine, bien qu’incapacitant transitoirement certaines fibres nerveuses, n’est souvent pas le traitement idéal espéré pour s’opposer aux excès de néo-innervations (voir infra).
Le rôle de chef d’orchestre des nerfs dans le turn-over osseux tissulaire est capital et illustré en pathologie par les algodystrophies, arthropathies nerveuses, et pseudarthroses atrophiques
Diverses pathologies osseuses illustrent la capacité de certaines fibres nerveuses à induire une hyper-vascularisation et à accélérer le turn-over cellulaire de manière aiguë (dans les algodystrophies) et suraiguë (arthropathies nerveuses). Lors de ces dernières, la libération antidromique massive d’enképhalines et de divers peptides (substance P, CGRP, etc.), combinée à un défaut de synthèse acquis de facteurs de croissance nerveux, peut induire des remaniements extrêmement rapides et prononcés de l’os sous-chondral (des articulations ou des plateaux vertébraux), aboutissant à la fonte des épiphyses et/ou à la fracture des os de voisinage, avec déstabilisation de l’articulation (formes atrophiques). Ces premières phases peuvent être suivies de processus de reconstructions rapides et anarchiques, parfois au premier plan (formes hypertrophiques). Ces reconstructions débutent souvent avant même que la phase de destruction soit achevée, du fait de la libération simultanée par l’extrémité distale du nerf, et/ou les ostéocytes sous leur contrôle, de molécules activant tant les ostéoblastes que les ostéoclastes. Le rôle trophique des nerfs en rhumatologie peut aussi être illustré par des phénomènes observés chez les animaux et êtres humains adultes : l’absence de nerfs dans un cal aboutit souvent à une pseudarthrose atrophique, qui peut être prévenue dans des modèles murins par l’injection locale de NGF (33).
Ce n’est pas un hasard si ces trois exemples concernent le tissu osseux, puisque c’est celui où le rôle trophique des nerfs paraît le plus important (34). Le NGF y stimule à la fois les ostéoblastes et les ostéoclastes, tandis que le BDNF stimule surtout les cellules endothéliales et les cellules souches (34). La substance P et la CGRP activent aussi les cellules souches osseuses, la CGRP activant en plus directement les ostéoblastes tout en inhibant les ostéoclastes (et pourrait donc peut-être jouer un rôle dans les formes hypertrophiques d’ostéo-arthropathies nerveuses). Les peptides libérés par les fibres sympathiques favorisent, au contraire, plutôt une activité de résorption : la noradrénaline active le remodelage osseux, et tant le peptide Y que l’acétyl-choline activent les ostéoclastes (34).
Une des raisons pour lesquelles l’os (notamment sous-chondral) est le tissu le plus concerné par le phénomène de néo-innervation tient au fait que les ostéoclastes activés libèrent des molécules extra-cellulaires contenant d’autres facteurs de croissance que les neurotrophines (comme l’EGFR) (35). Ceci peut contribuer à entretenir un cercle vicieux d’excès de néo-innervation conduisant à un hyper-remodelage avec nouvelle activation des ostéoclastes (35). Ceci explique peut-être pourquoi les fractures d’ostéophytes du rachis peuvent être particulièrement douloureuses, la néo-innervation au sein de ces ostéophytes étant encore plus riche que ne l’est l’innervation dans un os normal.
Mais le rôle trophique des nerfs vaut aussi pour les tendons et les disques intervertébraux
Il est peut-être moins connu qu’une dénervation d’un tendon peut aussi favoriser un défaut de sa cicatrisation (équivalent de “pseudarthrose du tendon”). Ceci tient au fait que normalement des nerfs GAP43+ facilitent la migration de cellules inflammatoires de détersion de la zone du tendon lésé, puis que des nerfs CGRP+ facilitent ensuite la prolifération de fibroblastes cicatriciels (36).
Réciproquement, un excès de remodelage induit par la néoinnervation pourrait ne pas concerner que l’os. Il a par exemple déjà été émis l’hypothèse que certaines néo-innervations discales excessives pourraient aussi participer à des phénomènes de discopathies rapidement destructrices (37), par épuisement des chondrocytes discaux, en particulier dans les nucleus contenant trop de mastocytes (qui peuvent libérer beaucoup de NGF). Les mastocytes sont de fait les cellules de la réponse immune les plus représentées dans les disques les plus dégénérés (38, 39).
Le rôle trophique des nerfs est aussi illustré par leur importance dans l’embryogenèse, jusqu’à la persistance de fibres nerveuses formant des synapses avec les chondrocytes dans les cartilages épiphysaires des rats nouveaux-nés
Les nerfs sensitifs jouent un rôle majeur dans l’embryogenèse de certains tissus conjonctifs : d’abord des nerfs exprimant le récepteur au NGF exprimant du CGRP, puis des nerfs sympathiques libérant du neuropeptide Y (36). Ceci semble valoir surtout pour l’os cortical, comme illustré par la topographie des coulées d’hyperostose dans les mélorhéostoses (durant lesquelles les zones corticales touchées sur un membre suivent le trajet d’un métamère nerveux).
Ceci vaut toutefois sans doute aussi pour l’os sous-chondral : des fibres nerveuses myélinisées y sont encore visibles 10 jours après la naissance des rats, qui viennent au contact des chondrocytes (même si elles régressent ensuite rapidement après la naissance, conjointement avec la maturation des chondrocytes) (40). Durant cette période de régression des nerfs du cartilage fœtal, ceux-ci libèrent dans la matrice cartilagineuse de la substance P et du CGRP par leurs fibres peptidergiques, et du neuropeptide NPY par leurs fibres sympathiques (40). Comprendre quelles sont les fonctions trophiques de ces molécules sur les chondrocytes fœtaux serait très utile.
Il serait toutefois encore plus intéressant de savoir quelles autres molécules sont libérées/exprimées par les chondrocytes, juste après la naissance (lors du passage en métabolisme aérobie), et poussent ces nerfs trophiques (mais aussi sensitifs, et donc sources potentielles de nociception), à fuir le tissu cartilagineux des rats nouveaux-nés. Ceci pourrait en effet aider à la mise au point de molécules simulant ce phénomène tant au niveau de l’os sous-chondral dans les arthroses et discarthroses que peut-être aussi d’autres tissus. Il se pourrait que certains protéoglycanes fassent partie de ces magic bullets : dans des modèles animaux de discopathies, la perte en protéoglycanes dans le nucleus, mais encore plus dans l’annulus, facilite en effet la migration de fibres nociceptives (41, 42).
Quels signaux incitent les nerfs à pénétrer dans des tissus normalement non ou peu innervés ? Quels signaux orientent le sprouting initié par les neurotrophines ?
Les neurotrophines
Comme déjà évoqué, les premiers messagers chimiques historiquement décrits comme facilitant le sprouting excessif de fibres nerveuses dans les tissus ont été diverses neurotrophines : NGF, BDNF, GDNF, et NT3. Elles sont logiquement libérées par les nerfs lésés (43), mais peuvent aussi l’être par les cellules gliales dans le système nerveux central ou le ganglion spinal (44), et avec, alors, des expressions cliniques souvent plus bruyantes. Par exemple, quand une lésion des cellules gliales autour des noyaux des racines sciatiques induit un sprouting de fibres sympathiques au sein du ganglion spinal (44), des douleurs en éclairs spontanées viennent souvent se greffer aux douleurs chroniques déjà induites par les fibres autres que sympathiques.
Les neurotrophines peuvent surtout être aussi libérées par les tissus lésés (os, tendon, disques) eux-mêmes (Fig. 2), en particulier en conditions hyperosmolaires (42), ou inflammatoires (notamment en cas de concentrations élevées d’IL-1). Comme déjà évoqué, la libération massive de neurotrophines est souvent le fait initialement des cellules de réparation tissulaire que sont les mastocytes tissulaires (qui non seulement secrètent aussi beaucoup du NGF, mais sont également sensibles de manière autocrine au NGF, car les mastocytes expriment également le récepteur au NGF) (11).
Il est bienvenu de rappeler que pour que ces neurotrophines facilitent le sprouting, il faut aussi que les cellules cibles (dont les terminaisons nerveuses) en expriment les récepteurs : TrkA pour le NGF, TrkB pour le BDNF, Ret pour le GDNF. Il faut par ailleurs que ces neurotrophines ne soient pas d’abord captées par d’autres récepteurs (dont TrkA et TrkB) que ceux des nerfs, car les nerfs n’en n’ont pas l’exclusivité, comme déjà évoqué pour les mastocytes. En effet, le rôle trophique du NGF, du BDNF et des autres neurotrophines ne s’exerce pas uniquement sur les nerfs, contrairement à ce que leur appellation pourrait faire croire.
Cette remarque vaut également pour certains neuromédiateurs comme la substance P, d’une part car ces neuromédiateurs peuvent eux-mêmes avoir un rôle trophique (au moins sur les tendons), et d’autre part, car ce rôle trophique ne s’exerce que si le tissu cible en possède le récepteur : par exemple le récepteur NK1 (très exprimé par les ténocytes) pour la substance P, et le récepteur NMDA de type R1 (aussi très exprimé par les ténocytes) pour le glutamate (11).
Ces surexpressions de neurotrophines et de neuromédiateurs surviennent initialement conjointement avec un processus d’inflammation (arrivée de monocytes, puis d’autres cellules de la réponse immune avec sécrétion de cytokines et chémokines), lui-même secondaire aux lésions tissulaires. À ce stade précoce, inflammation et néo-innervation se renforcent mutuellement (Fig. 2). Une amplification du sprouting initial par la présence de cellule de réponse immune a, entre autres, été observée dans le disque intervertébral (27).
Toutefois l’inflammation n’est, à plus long terme, pas indispensable à la persistance de la néo-innervation, ces deux phénomènes devenant alors indépendants. Ceci explique l’absence fréquente d’œdèmes sous-chondraux dans les arthroses douloureuses, et de signaux anormaux dans les tendinoses chroniques, comme d’aspect MODIC2 chez beaucoup de lombalgiques chroniques.
Certains produits de l’inflammation peuvent même physiologiquement finir par s’opposer à la néo-innervation, même si ceci ne survient pas au tout début de l’inflammation : par exemple diverses métalloprotéases, dont MMP2 et MMP9, dégradent le NGF (45).
La netrine-1, les éphrines, et les sémaphorines
La libération de neurotrophines et leur gradient de concentration, à partir de la zone lésée, ne suffisent pas à l’induction d’un sprouting efficace : la croissance de la néo-innervation doit aussi être guidée/stimulée par des molécules variées. Le fait qu’elles aient également d’autres fonctions que ce simple guidage devra toutefois rendre prudent quant à leur ciblage thérapeutique éventuel pour tenter d’inhiber les excès de néo-innervation dans les tissus lésés.
MOG
Une première de ces molécules est MOG, qui est en quelque sorte une “éponge à NGF” présente à la surface des gaines de myéline, permettant à cette gaine résiduelle de stocker du NGF pour aider des fibres nerveuses à la recoloniser après dégénérescence de l’axone précédent (46). Cette molécule, surtout opérationnelle dans le cerveau, n’a sans doute que peu ou pas d’importance dans les douleurs chroniques autres que les radiculalgies et syndromes canalaires concernant des fibres myélinisées.
Autres molécules
Les autres molécules de guidage connues à ce jour sont plus importantes, car elles sont libérées (entre autres) par les tissus de l’appareil locomoteur, et ne nécessitent par la présence résiduelle de gaines de myéline préexistantes. Il s’agit surtout des nétrines, éphrines, et sémaphorines, la voie wnt paraissant également impliquée.
Leur effet sur la néo-innervation n’est pas univoque, car il dépend (comme pour les neurotrophines), de l’expression de récepteurs à la surface des fibres nerveuses. Selon la nature de ces récepteurs, les effets de ces molécules peuvent être diamétralement opposés sur la néo-innervation, et la survenue ou non de douleurs chroniques. Par exemple, la nétrine-1 a un effet très attracteur sur les dendrites nerveuses exprimant le récepteur DCC, mais a par contre un effet répulsif sur les axones exprimant le récepteur UNC5H2, la liaison à la nétrine-1 pouvant alors aller jusqu’à la mort du neurone (47).
La nétrine-1
La nétrine-1 est physiologiquement surtout produite dans le cerveau, mais elle l’est aussi par les tissus de l’appareil locomoteur, sièges d’une néo-innervation pathologique : cellules du nucleus pulposus, ostéoclastes des plateaux vertébraux et des os sous-chondraux, et monocytes-macrophages (47), en particulier en situation d’hypoxie (48). La nétrine-1 semble jouer un rôle majeur dans la néo-innervation des plateaux vertébraux induite par l’activation des ostéoclastes (49).
Inhiber localement la nétrine-1 (injections intra-articulaires ou intra-discales d’inhibiteurs) pourrait peut-être éviter la survenue d’une néo-innervation excessive dans ces tissus, mais la forte présence de la nétrine-1 dans le cerveau, et ses fonctions pléiotropes dans de nombreux tissus, pourrait rendre son blocage systémique bien plus hasardeux.
Les effets attracteurs de la nétrine-1 au sein des disques semblent surtout marqués si la concentration locale d’interleukine 1 et/ou de TNF est élevée. Ceci suggère que l’effet majorant de la nétrine-1 sur la néo-innervation pourrait être en bonne part inhibé par le blocage très précoce de l’IL-1 (50), au moins dans le contexte des lombalgies discales.
Éphrines, sémaphorines et voie wnt
Comme déjà évoqué, la plupart des autres molécules concourant à la néo-innervation avec les neurotrophines ont d’autres fonctions que d’attirer et guider la néo-innervation. Par exemple les éphrines et la voie wnt participent beaucoup au couplage entre l’action des ostéoclastes, puis des ostéoblastes (51). Ceci n’est pas un hasard, car le renouvellement de l’os est aussi contrôlé en partie par le système nerveux.
Les sémaphorines sont d’autres catégories de molécules facilitant ou inhibant le sprouting. La sémaphorine 3A a plutôt un effet répulsif sur la néo-innervation. Son absence favorise une néo-innervation, et une néo-vascularisation excessive, avec excès de turn-over métabolique et dégénérescence discale précoce (52, 53).
Par contre, un excès de sémaphorines 3C et 3D attractives, et/ou de leur récepteur, la neuropiline-2, est associé à une néo-innervation excessive du nucleus (27).
Les récepteurs à la nétrine-1, aux éphrines, aux sémaphorines, et de la voie wnt ne font pas que guider et faciliter ou inhiber le sprouting. Ils modulent aussi l’excitabilité des neurones, et sont également exprimés par les neurones du système nerveux central (cerveau, moelle) ainsi que par les cellules de la réponse immune (54). Leur modulation pourrait donc être aussi utile à contrer les douleurs neuropathiques et/ou neuroplastiques secondaires aux néo-innervations induites par les excès d’inflammation (54). Toutefois, leur présence ubiquitaire et leurs effets pléiotropiques devront aussi inciter à la prudence si l’on tente de les inhiber.
L’angiotensine
L’angiotensinogène n’est pas synthétisé seulement dans les vaisseaux. Il est aussi fabriqué dans les tissus par les lymphocytes T et B, tandis que la rénine l’est par les macrophages. Les échanges entre ces cellules immunitaires peuvent donc induire la libération d’angiotensine I, qui peut être ensuite transformée en angiotensine II dans les tissus lésés par la chymase des mastocytes. L’angiotensine II favorise alors divers sproutings in vitro, dont de neurones TRPV1+, qui expriment fortement le récepteur à l’angiotensine II (55, 56). Les études menées sur ce thème chez l’homme ont surtout porté sur le rôle de l’angiotensine dans l’induction ou l’entretien des douleurs neuropathiques. Leurs conclusions ont été contrastées (57) et plutôt négatives. Toutefois, l’incidence des excès de synthèse d’angiotensine II dans les tissus de l’appareil locomoteur sur le sprouting dans les tissus mériterait d’autant plus d’être étudiée que dans une étude sur les exomes prédisposant à un seuil plus bas de douleurs aux stimuli thermiques dans la population générale, les gènes les plus associés à la présence de douleurs chroniques inexpliquées codaient justement pour des molécules régulant la synthèse d’angiotensine (58).
Quels mécanismes autres que physiques pourraient induire un sprouting excessif chez les douloureux chroniques ?
Une première explication à la survenue ou non d’une néo-innervation chronique dans les disques/tendons/os sous-chondraux pourrait être des combinaisons variées de polymorphismes génétiques favorisant un excès de synthèse de certaines neurotrophines, nétrines, sémaphorines, angiotensines, et/ou d’expression de leurs récepteurs.
Une deuxième explication à la présence d’une néo-innervation seulement chez certaines personnes (les douloureux chroniques), à lésions structurales paraissant par ailleurs égales, pourrait être un défaut ou retard de synthèse, dans les tissus sources de ces douleurs chroniques, d’inhibiteurs de la néo-innervation, comme par exemple un défaut de synthèse en certains protéoglycanes. Dans des modèles animaux, la perte en certains protéoglycanes dans le nucleus, mais encore plus dans l’annulus, facilite en effet la migration de fibres nociceptives (41). Toutes les recherches en cours sur les meilleurs moyens d’aider au mieux les tissus à cicatriser (comme l’injection de cellules souches entourées d’une matrice idoine, et capables de relancer une synthèse de protéoglycanes sains), pourraient donc avoir aussi des effets bénéfiques sur l’obtention d’une indolence durable.
Une autre explication pourrait être un excès focal de facteurs exogènes poussant les cellules innées à une inflammation a minima (avec libération chronique d’IL-1) favorisant la survenue d’une néo-innervation. Il pourrait notamment s’agir d’antigènes de microorganismes des microbiotes et/ou de leurs métabolites. On retrouve en effet des traces d’ADN de microbiote dans des tissus présumés antérieurement stériles, dont l’os sous-chondral, mais aussi le nucleus discal. Cette hypothèse cadrerait bien avec les découvertes récentes d’un rôle du microbiote digestif dans les arthroses systémiques. La mise en culture ex vivo de Cutiabacterium acnes (la bactérie du microbiote ayant le plus de capacité à migrer des muqueuses humaines dans les tissus et d’y persister) avec des chondrocytes discaux induit de fait la synthèse par ces cellules discales non seulement d’IL-1, d’IL-6, d’IL-8, mais aussi de NGF et de BDNF (59).
Divers stress physiques et chimiques favorisent aussi le phénomène de sprouting
Il a été montré dans des modèles animaux de discopathies, et/ou de souffrances des chondrocytes discaux, qu’un excès de pression contribuait à la survenue d’un sprouting, avec excès de synthèse de NGF, et aussi d’IL-1/IL-6 (60) et de CGRP in vivo chez l’homme (61). L’activité physique sans excès de pression réduit par contre le sprouting au sein des disques, comme observé chez le rat (62).
Ceci va dans le sens des observations faites par les cliniciens : effets néfastes des efforts trop intensifs, mais bénéfiques des activités plus modérées, dont la marche.
Les conditions hyperosmolaires favorisent aussi le sprouting, ce qui est une des raisons devant inciter les personnes exerçant un travail physique à bien s’hydrater, comme le font les sportifs.
Quels traitements systémiques déjà disponibles ont-ils un effet possible ou probable sur le sprouting ?
Un blocage précoce de l’interleukine 1 pourrait avoir des effets préventifs sur la néo-innervation dans beaucoup de contextes, car l’IL-1 in vitro majore la synthèse des neurotrophines (NGF, BDNF, GDNF), ainsi que de diverses sémaphorines. Cette synthèse d’IL-1 est accrue en cas de calcifications intra-discales, défauts de nutrition du disque, hypoxies-acidoses chroniques, ou déshydratations, et toutes les autres causes de présence de macrophages de type M1.
La capsaïcine induit une dégénérescence de certaines des fibres sensitives nociceptives afférentes en se liant de manière pérenne aux récepteurs TRPV1, ceci aboutissant à une désensibilisation des seconds neurones aux stimuli thermiques ou chimiques. La capsaïcine a de ce fait une efficacité partielle dans des douleurs neuropathiques, comme celles induites par les infections herpétiques ou le virus d’immunodéficience humaine (VIH), ou certaines neuropathies diabétiques. Toutefois, concernant la France, la Haute Autorité de santé (HAS) n’a pas jugé l’amélioration assez significative pour motiver un remboursement. Cette dégénérescence n’est par ailleurs que transitoire et incomplète, car les fibres nerveuses inhibées par la capsaïcine sont encore capables, par un mécanisme qui reste à préciser, d’inhiber le sprouting de fibres nociceptives de nerfs de voisinage dans la zone partiellement dénervée (63). Les effets des applications topiques de capsaïcine sur les douleurs chroniques en rhumatologie restent d’autant plus mitigés que :
• son application provoque une activation transitoire des douleurs par activation passagère des récepteurs TRPV1 ;
• elle n’induit que peu ou pas de régression des sproutings pré-existants, un rebond de douleurs survenant de manière différée (la durée de l’amélioration étant proportionnelle à la dose appliquée) ;
• l’effet inhibiteur différé de la capsaïcine ne vaut pas pour toutes les fibres nociceptives, et le déséquilibre au sein d’un nerf entre les diverses fibres le constituant peut avoir comme effet pervers d’induire au contraire des douleurs, comme déjà évoqué (32).
La disparition des fibres n’est pas synonymes d’indolence ! Exemple des syndromes des petites fibres
Même si les phénomènes quantitatifs de néo-innervations pathologiques jouent un rôle sans doute majeur dans la pathogénie des lombalgies chroniques, des douleurs arthrosiques, et des douleurs tendineuses chroniques, l’aspect qualitatif de la néo-innervation est également capital pour expliquer la survenue ou non, voire persistance ou non, de douleurs chroniques. Il faudra donc, à l’avenir, juger surtout du résultat clinique obtenu des essais d’inhibition du sprouting, et non seulement du degré de dénervation obtenu en histologie.
Dans les syndromes dits des petites fibres, à l’origine parfois de très vives douleurs, on observe en effet, et paradoxalement, une raréfaction du nombre de petites fibres polymodales C peptidergiques au sein de l’épiderme (ainsi que dans l’épithélium cornéen). Pourtant, les patients souffrent d’une allodynie, souvent sévère, aux stimuli mécaniques. Persistent en effet dans la peau des fibres non peptidergiques qui deviennent beaucoup plus sensibles aux stimuli mécaniques (du fait de la disparition d’autres fibres à fonction surtout inhibitrices). Les fibres résiduelles pourraient être la source de douleurs, du fait, entre autres, :
• d’une plus grande susceptibilité de ces neurones persistant au GDNF par leur récepteur Ret (et peut-être aussi au NGF via la liaison à TrkA)
• et de leur moindre expression des récepteurs inhibiteurs à l’adénosine A1, et à la phosphatase acide prostatique (qui co-localisent avec TRPV1, et disparaissent souvent simultanément avec la dé-expression de TRPV1, le canal sodique activateurs des nerfs) (64).
La séquence pathogénique actuellement privilégiée pour expliquer la pathogénie des syndromes des petites fibres est en effet la déplétion de ces récepteurs TRPV1 à la surface des nerfs, du fait de divers “neurotoxiques” (qui pourraient être parfois des auto-anticorps). S’en suit une sous-expression des récepteurs inhibiteurs (à l’adénosine-1 et à la phosphatase acide prostatique) à l’origine des douleurs. Survient conjointement une surexpression du facteur d’activation de la transcription 3, qui inhibe la survie de certaines fibres nerveuses, et rend compte de la raréfaction “paradoxale” d’autres petites fibres, plus inhibitrices, dans la peau et la cornée (64).
Il est aussi probable qu’il existe dans ces contextes un déséquilibre entre la disparition de certaines de ces fibres inhibitrices somatiques et la persistance des fibres excitatrices sympathiques, qui sont par ailleurs aussi sensibles que les fibres non sympathiques au NGF (65).
Les études quantitatives ex vivo sur la néo-innervation, si elles sont indispensables pour détecter des molécules candidates à un ciblage thérapeutique (et probablement à la mise au point de cocktails de molécules inhibitrices des excès de néo-innervation), ne pourront donc remplacer les essais cliniques.
Conclusion
Le sujet de la néo-innervation pathologique des tissus de l’appareil locomoteur et de son inhibition reste encore un thème (très) ardu, et il relève plus de l’avenir que du présent pour le clinicien. C’est toutefois sûrement un des sujets les plus importants en rhumatologie (c’est dans l’os le plus dur que l’on trouve la moelle la plus exquise).
Après une phase d’espoirs excessifs placés dans le blocage (naïf) du seul NGF par des anticorps anti-NGF (qui ne sont très efficaces qu’au prix de troubles trophiques parfois sévères de l’os sous-chondral, ressemblant à ceux pouvant survenir chez les patients “souffrant” de certaines insensibilités congénitales à la douleur), les nombreuses études fondamentales en cours faciliteront la mise au point de traitements limitant les excès de néo-innervation, en tenant plus compte du rôle dual de l’innervation sensitive :
• renseigner l’organisme de l’existence d’un danger inhérent aux lésions tissulaires ;
• mais aussi assurer/orchestrer la réparation tissulaire, par la libération en distalité de certains nerfs de diverses molécules ayant des effets trophiques autant qu’algogènes.
L’antagonisation des néo-innervations excessives n’est donc pas antinomique, au contraire, avec tous les travaux menés pour essayer de repeupler les tissus lésés avec des cellules souches et des matrices plus jeunes, car il est probable que des molécules bénéfiques libérées physiologiquement par des chondrocytes, ténocytes, ou ostéocytes/blastes/clastes sains venant réparer les tissus, soient parmi les meilleures inhibitrices des phénomènes de néo-innervations pathologiques (dont certains protéoglycanes).
Il faudra surtout mieux savoir dès que possible :
• quelles combinaisons de molécules (à inhiber) contribuent en pathologie à faire passer la néo-innervation initialement bénéfique au stade de néo-innervation excessive ou persistante ;
• quelles molécules (à utiliser) permettent physiologiquement (mais à une vitesse variable selon les individus) de faire fuir les nerfs au sein de certains tissus (comme observé chez le rat nouveau-né autour des chondrocytes).
Il faudra enfin apprendre à quel moment, et pour chaque tissu, il est optimal d’antagoniser les inducteurs de néo-innervations, par des traitements peut-être systémiques, mais plus probablement purement locaux (par exemple injections échoguidées), pour éviter des effets toxiques sur le système nerveux central. Ces traitements locaux par topiques ou injections pourraient avoir aussi comme intérêt de compléter l’action des essais de dénervations péri-tissulaires parfois tentés pour soulager des douleurs chroniques (radiofréquences et alcoolisation), qui ne mettent pas à l’abri à eux seuls d’une récidive de phénomènes de sprouting.
L’auteur n’a pas déclaré de lien d’intérêt pour cet article.
Bibliographie
1. Jimenez-Andrade JM, Mantyh PW. Sensory and sympathetic nerve fibers undergo sprouting and neuroma formation in the painful arthritic joint of geriatric mice. Arthritis Res Ther 2012 ; 14 ; R101.
2. Vincent TL. Peripheral pain mechanisms in osteoarthritis. Pain 2020 ; 161 : S138-46.
3. Roeckel LA, Le Coz GM, Gavériaux-Ruff C, Simonin F. Opioid-induced hyperalgesia: Cellular and molecular mechanisms. Neuroscience 2016 ; 338 : 160-82.
4. Bauman BD, Meng J, Zhang L et al. Enteric glial-mediated enhancement of intestinal barrier integrity is compromised by morphine. J Surg Res 2017 ; 219 : 214-21.
5. Muchhala K, Kang M, Koseli E et al. The Role of Morphine-Induced Impairment of Intestinal Epithelial Antibacterial Activity in Dysbiosis and its Impact on the Microbiota-Gut-Brain Axis. Res Sq 2023 ; rs.3.rs-3084467.
6. Berthelot JM, Sellam J, Maugars Y et al. Cartilage-gut-microbiome axis: a new paradigm for novel therapeutic opportunities in osteoarthritis. RMD Open 2019 ; 5 : e001037.
7. Arzola-Martinez L, Ptaschinski C, Lukacs NW. Trained innate immunity, epigenetics, and food allergy. Front Allergy 2023 ; 4 : 1105588.
8. Mora VP, Loaiza RA, Soto JA et al. Involvement of trained immunity during autoimmune responses. J Autoimmun 2023 ; 137 : 102956.
9. Freemont AJ, Peacock TE, Goupille P et al. Nerve ingrowth into diseased intervertebral disc in chronic back pain. Lancet 1997 ; 350 : 178-81.
10. Sun K, Jiang J, Wang Y et al. The role of nerve fibers and their neurotransmitters in regulating intervertebral disc degeneration. Ageing Res Rev 2022 ; 81 : 101733.
11. Ackermann PW, Alim MA, Pejler G et al. Tendon Pain. What are the mechanisms behint it? Scand J Pain 2022 ; 23 : 14-24.
12. Aso K, Shahtaheri SM, Hill R et al. Contribution of nerves within osteochondral channels to osteoarthritis knee pain in humans and rats. Osteoarthritis Cartilage 2020 ; 28 : 1245-54.
13. Morgan M, Nazemian V, Harrignton K et al. Mini review: The role of sensory innervation to subchondral bone in osteoarthritis pain. Front Endocrinol (Lausanne) 2022 ; 13 : 1047943.
14. Lane NE, Schnitzer TJ, Birbara CA et al. Tanezumab for the treatment of pain from osteoarthritis of the knee. N Engl J Med 2010 ; 363 : 1521-31.
15. Berenbaum F, Schnitzer TJ, Kivitez AJ et al. General Safety and Tolerability of Subcutaneous Tanezumab for Osteoarthritis: A Pooled Analysis of Three Randomized, Placebo-Controlled Trials. Arthritis Care Res (Hoboken) 2022 ; 74 : 918–28.
16. Markman JD, Bolash RB, McAlindon TE et al. Tanezumab for chronic low back pain: a randomized, double-blind, placebo- and active-controlled, phase 3 study of efficacy and safety. Pain 2020 ; 161 : 2068-78.
17. Testa G, Cattaneo A, Capsoni S. Understanding pain perception through genetic painlessness diseases: The role of NGF and proNGF. Pharmacol Res 2021 ; 169 : 105662.
18. Mantyh PW. Mechanisms that drive bone pain across the lifespan. Br J Clin Pharmacol 2019 ; 85 : 1103–13.
19. Barker PA, Mantyh PW, Arendt-Nielsen L et al. Nerve Growth Factor Signaling and Its Contribution to Pain. J Pain Res 2020 ; 13 : 1223–41.
20. Kalous A, Nangle MR, Anastasis A, et al. Neurotrophic actions initiated by proNGF in adult sensory neurons may require peri-somatic glia to drive local cleavage to NGF. J Neurochem 2012 ; 122 : 523-36.
21. Gan Y, He J, Zhu J et al. Spatially defined single-cell transcriptional profiling characterizes diverse chondrocyte subtypes and nucleus pulposus progenitors in human intervertebral discs. Bone Res 2021 ; 9 : 37.
22. Spang C, Chen J, Backman LJ. The tenocyte phenotype of human primary tendon cells in vitro is reduced by glucocorticoids. BMC Musculoskelet Disord 2016 ; 17 : 467.
23. Chen L, Ni Z, Huang J, et al. Long term usage of dexamethasone accelerating accelerates the initiation of osteoarthritis via enhancing chondrocyte apoptosis and the extracellular matrix calcification and apoptosis of chondrocytes. Int J Biol Sci 2021 ; 17 : 4140-53.
24. Chen M, Fu W, Xu H, et al. Pathogenic mechanisms of glucocorticoid-induced osteoporosis. Cytokine Growth Factor Rev 2023 ; 70 : 54-66.
25. Levy BJ, McCarthy MB, Lebaschi A, et al. Subacromial Bursal Tissue and Surrounding Matrix of Patients Undergoing Rotator Cuff Repair Contains Progenitor Cells. Arthroscopy 2022 ; 38 : 1115-23.
26. Hong D, Byers MR, Oswald RJ. Dexamethasone treatment reduces sensory neuropeptides and nerve sprouting reactions in injured teeth. Pain 1993 ; 55 : 171-81.
27. Binch ALA, Cole AA, Breakwell LM, et al. Expression and regulation of neurotrophic and angiogenic factors during human intervertebral disc degeneration. Arthritis Res Ther 2014 ; 16 : 416.
28. Yang H, Zeng Q, Silverman HA et al. HMGB1 released from nociceptors mediates inflammation. Proc Natl Acad Sci U S A 2021 ; 118 : e2102034118.
29. Onizuka C, Irifune M, Mukai A et al. Pentobarbital may protect against neurogenic inflammation after surgery via inhibition of substance P release from peripheral nerves of rats. Neurosci Lett 2022 ; 771 : 136467.
30. Jozefowicz LM, Nedoszvtko B, Grochocka M, et al. Molecular Mechanisms of Neurogenic Inflammation of the Skin. Int J Mol Sci 2023 ; 24 : 5001.
31. Dansereau MA, Midavaine E, Bégin-Lavallée V et al. Mechanistic insights into the role of the chemokine CCL2/CCR2 axis in dorsal root ganglia to peripheral inflammation and pain hypersensitivity. J Neuroinflammation 2021 ; 18 : 79.
32. Botz B, Kriszta G, Bölcskei K, et al. Capsaicin-Sensitive Peptidergic Sensory Nerves Are Anti-Inflammatory Gatekeepers in the Hyperacute Phase of a Mouse Rheumatoid Arthritis Model. Int J Mol Sci 2021 ; 22 : 1682.
33. Rivera KO, Russo F, Boileau RM, et al. Local injections of β-NGF accelerates endochondral fracture repair by promoting cartilage to bone conversion. Sci Rep 2020 ; 10 : 22241.
34. Liu F, Liu S, Li S et al. Nerves within bone and their application in tissue engineering of bone regeneration. Front Neurol 2023 ; 13 : 1085560.
35. Neto E, Leitao L, Mateus JC et al. Osteoclast-derived extracellular vesicles are implicated in sensory neurons sprouting through the activation of epidermal growth factor signaling. Cell Bioscience 2002 ; 12 : 127.
36. Rajpar I, Tomlinson RE. Function of peripheral nerves in the development and healing of tendon and bone. Semin Cell Dev Biol 2022 ; 123 : 48-56.
37. Zhang S, Hu B, Liu W et al. The role of structure and function changes of sensory nervous system in intervertebral disc-related low back pain. Osteoarthritis Cartilage 2021 ; 29 : 17-27.
38. Lan T, Hu Z, Guo W, et al. Development of a Novel Inflammatory-Associated Gene Signature and Immune Infiltration Patterns in Intervertebral Disc Degeneration. Oxid Med Cell Longev 2022 ; 2481071.
39. Wiet MG, Piscioneri A, Khan SN, et al. Mast Cell-Intervertebral disc cell interactions regulate inflammation, catabolism and angiogenesis in Discogenic Back Pain. Sci Rep 2017 ; 7 : 12492.
40. Wang Z, Liu B, Lin K, et al. The presence and degradation of nerve fibers in articular cartilage of neonatal rats. J Orthop Surg Res 2022 ; 17 : 331.
41. Lama P, Le Maitre CL, Harding IJ, et al. Nerves and blood vessels in degenerated intervertebral discs are confined to physically disrupted tissue. J Anat 2018 ; 233 : 86-97.
42. Purmessur D, Cornejo MC, Cho SK, et al. Intact glycosaminoglycans from intervertebral disc-derived notochordal cell-conditioned media inhibit neurite growth while maintaining neuronal cell viability. Spine J 2015 ; 15 : 1060-9.
43. Poublon, AR, Walbeehm ET, Duraku LS et al. The anatomical relationship of the superficial radial nerve and the lateral antebrachial cutaneous nerve: A possible factor in persistent neuropathic pain. J Plast Reconstr Aesthet Surg 2015 ; 68 : 237-42.
44. Zheng Q, Xie W, Lückemeyer DD et al. Synchronized cluster firing, a distinct form of sensory neuron activation, drives spontaneous pain. Neuron 2022 ; 110 : 209-220.e6.
45. Osikowicz M, longo G, Allard S et al. Inhibition of endogenous NGF degradation induces mechanical allodynia and thermal hyperalgesia in rats. Mol Pain 2013 ; 13 : 37.
46. Von Büdingen HC, Mei F, Greenfield A et al. The myelin oligodendrocyte glycoprotein directly binds nerve growth factor to modulate central axon circuitry. J Cell Biol 2015 ; 210 : 891-8.
47. Wu CH, Yuan XC, Gao F et al. Netrin-1 Contributes to Myelinated Afferent Fiber Sprouting and Neuropathic Pain. Mol Neurobiol 2016 ; 53 : 5640-51.
48. Rosenberger P, Scwhab JM, Mirakaj V et al. Hypoxia-inducible factor-dependent induction of netrin-1 dampens inflammation caused by hypoxia. Nat Immunol 2009 ; 10 : 195-202.
49. Zhu S, Zhu J, Zhen G et al. Subchondral bone osteoclasts induce sensory innervation and osteoarthritis pain. J Clin Invest 2019 ; 129 : 1076-93.
50. Zheng B, Li S, Xiang Y et al. Netrin-1 mediates nerve innervation and angiogenesis leading to discogenic pain. J Orthop Transl 2022 ; 39 : 21-33.
51. Iqbal J, Yuen T, Kim SM et al. Opening windows for bone remodeling through a SLIT. J Clin Invest 2018 ; 128 : 1255-7.
52. Yin P, Lv H, Zhang L et al. Semaphorin 3A: A Potential Target for Low Back Pain. Front Aging Neurosci 2015 ; 7 : 216.
53. Mima Y, Suzuki S, Fujii T et al. Potential involvement of semaphorin 3A in maintaining intervertebral disc tissue homeostasis. J Orthop Res 2019 ; 37 : 24258.
54. Damo E, Simonetti M. Axon Guidance Molecules and Pain. Cells 2022 ; 11 : 3143.
55. Anand U, Facer P, Yiangou Y et al. Angiotensin II type 2 receptor (AT2 R) localization and antagonist-mediated inhibition of capsaicin responses and neurite outgrowth in human and rat sensory neurons. Eur J Pain 2013 ; 17 : 1012-26.
56. Liao Z, Chakrabarty A, Mu Y et al. A Local Inflammatory Renin-Angiotensin System Drives Sensory Axon Sprouting in Provoked Vestibulodynia. J Pain 2017 ; 18 : 511-25.
57. Balogh M, Aguilar C, Nguyen NT et al. Angiotensin receptors and neuropathic pain. Pain Rep 2021 ; 6 : e869.
58. Williams FMK, Scollen S, Cao D et al. Genes contributing to pain sensitivity in the normal population: an exome sequencing study. PLoS Genet 2012 ; 8 : e1003095.
59. Cappoor MN, Konieczna A, McDowell A et al. Pro-Inflammatory and Neurotrophic Factor Responses of Cells Derived from Degenerative Human Intervertebral Discs to the Opportunistic Pathogen Cutibacterium acnes. Int J Mol Sci 2021 ; 22 : 2347.
60. Gawri R, Rosenzweig DH, Krock E et al. High mechanical strain of primary intervertebral disc cells promotes secretion of inflammatory factors associated with disc degeneration and pain. Arthritis Res Ther 2014 ; 16 : R21.
61. Miyagi M, Uchida K, Inoue S et al. A High Body Mass Index and the Vacuum Phenomenon Upregulate Pain-Related Molecules in Human Degenerated Intervertebral Discs Int J Mol Sci 2022 ; 23 : 2973.
62. Tian J, Yu T, Xu Y, et al. Swimming training reduced neuroma pain by regulating neurotrophins. Med Sci Sports Exerc 2018 ; 50 : 54-61.
63. Santha P, Lakatos S, Horvath A, et al. Perineural Capsaicin Treatment Inhibits Collateral Sprouting of Intact Cutaneous Nociceptive Afferents. Biomedicines 2022 ; 10 : 1326.
64. Chang CH, Chang YS, Hsieh YL. Transient receptor potential vanilloid subtype 1 depletion mediates mechanical allodynia through cellular signal alterations in small-fiber neuropathy. Pain Rep 2021 ; 6 : e922.
65. Nascimento FP, Magnussen C, Yousefpour N et al. Sympathetic fibre sprouting in the skin contributes to pain-related behaviour in spared nerve injury and cuff models of neuropathic pain. Mol Pain 2015 ; 11 : 59.




