Cet article explore les applications croissantes de l’intelligence artificielle (IA) en rhumatologie et ses limites.
En clinique, l’IA est une aide dans le diagnostic des maladies rhumatologiques grâce à l’analyse automatisée des images, à la détection précoce de pathologies inflammatoires ou la prédiction du risque fracturaire dans l’ostéoporose. Elle permet également d’établir des pronostics chez des patients à risque, de suivre l’évolution des maladies et d’anticiper les risques de poussée. En parallèle, des applications mobiles et des robots éducatifs offrent un soutien personnalisé aux patients.
Dans le domaine de la recherche, l’IA est une aide précieuse dans la veille scientifique, la traduction et l’illustration.
En enseignement, des simulateurs et générateurs de cas cliniques enrichissent la formation des rhumatologues en formation.
Des limites subsistent, notamment les biais des données d’entraînement, les problèmes d’interprétation des modèles complexes et les enjeux éthiques liés à la confidentialité des données médicales. De plus, l’impact écologique des technologies d’IA, lié à leur consommation énergétique, devient une préoccupation.
Il existe un certain nombre d’outils associés à l’IA à utiliser dans sa vie professionnelle, à adapter en fonction des pratiques de chacun. Cet article se veut une boîte à outils pour qui veut incorporer un peu (beaucoup) d’IA !
Introduction
L’intelligence artificielle
L’intelligence artificielle (IA) fait référence à l’ensemble des systèmes informatiques ayant la capacité à effectuer des tâches qui requièrent habituellement l’intelligence humaine, telles que l’apprentissage, le raisonnement ou la prise de décision. L’émergence de l’IA a marqué un tournant au cours des dernières années dans de nombreux domaines, dont la médecine et la recherche scientifique (1). De multiples applications de l’IA ont vu le jour en médecine, que ce soit pour le diagnostic, l’évaluation et le suivi des patients. Certaines spécialités médicales, comme la radiologie ou l’oncologie, utilisent déjà l’IA dans leur pratique quotidienne, permettant ainsi aux cliniciens de réaliser plus efficacement certaines tâches (2, 3).
L’intelligence artificielle en rhumatologie
La rhumatologie est une discipline dans laquelle l’utilisation de l’IA est encore discrète dans la pratique quotidienne. La recherche « Artificial Intelligence AND Rheumatology » sur Pubmed met en évidence 1 229 résultats, avec un pic de 346 publications au cours de l’année 2024, soit une hausse de 63 % par rapport à 2023. Un certain nombre d’études ont été menées dans différents domaines de la rhumatologie, que ce soit dans l’ostéoporose (détection de fractures, prédiction du risque) ou dans les rhumatismes inflammatoires chroniques (RIC) pour la sélection de profils de patients à risque et la prédiction du risque de progression structurale.
Cet article a pour objectif de décrire comment l’IA peut aider à la pratique de la rhumatologie, dans l’exercice clinique quotidien, les tâches administratives ou les missions d’enseignement et de recherche. Loin d’être exhaustif sur les possibilités de l’IA à ce jour et les aspects mécanistiques des algorithmes utilisés, cet article a pour objectif d’offrir une vision pratique pour les rhumatologues cherchant à intégrer ces outils dans leur routine professionnelle.
Applications globales de l’IA
Principes
L’IA repose sur des techniques permettant aux machines d’apprendre à partir des données, sans être explicitement programmées.
Les deux concepts centraux
Deux concepts centraux caractérisent ces technologies : l’apprentissage automatique (machine learning) et l’apprentissage profond (deep learning).
• L’apprentissage automatique désigne les méthodes par lesquelles les algorithmes apprennent à partir de données pour effectuer des tâches prédictives ou de classification.
• L’apprentissage profond, une sous-catégorie de l’apprentissage automatique, utilise des réseaux neuronaux artificiels multicouches pour analyser de grands volumes de données et extraire des caractéristiques complexes. Le deep learning est particulièrement utile pour le traitement d’images médicales ou la reconnaissance vocale (Fig. 1).
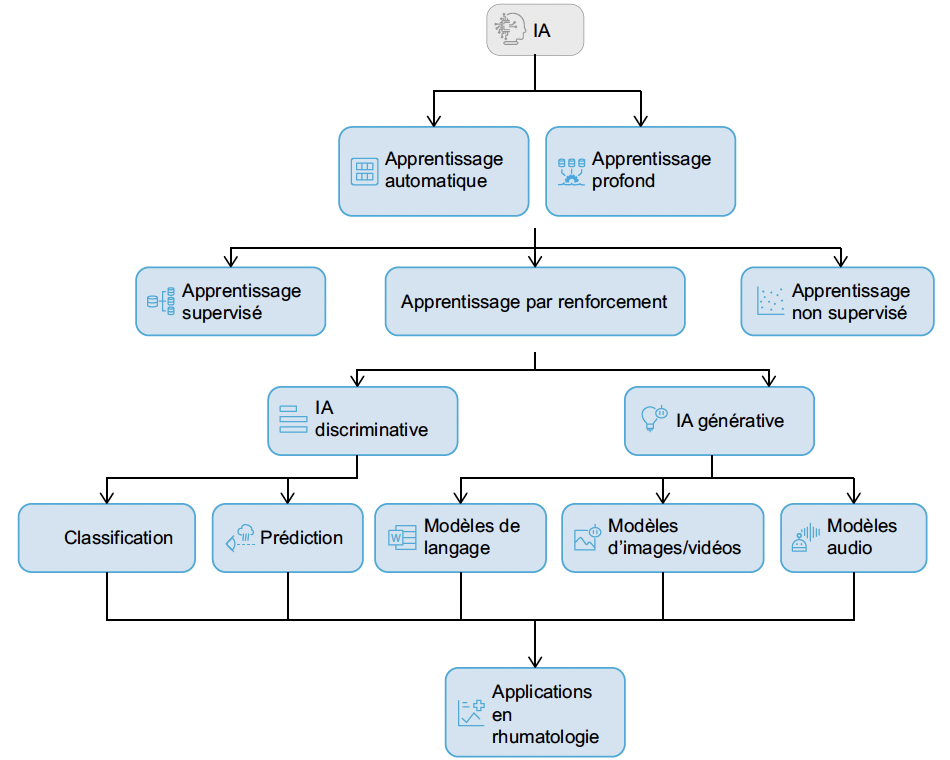
Figure 1 – Les modèles d’intelligence artificielle et quelques exemples d’applications.
Les trois approches principales d’apprentissage
On distingue trois approches principales d’apprentissage :
• l’apprentissage supervisé, qui utilise des données étiquetées pour entraîner les algorithmes,
• l’apprentissage non supervisé, qui cherche des structures ou des relations au sein de données non étiquetées,
• l’apprentissage par renforcement, où les modèles apprennent par essais et erreurs en maximisant des récompenses.
Les deux grandes branches
Ces méthodes alimentent deux grandes branches de l’IA que sont l’IA discriminative et l’IA générative (4) (Fig. 1). Ces deux approches ne sont pas exclusives et peuvent se combiner entre elles.
• L’IA discriminative se concentre sur l’identification ou la classification en analysant les relations entre les entrées (les données) et les sorties pour prédire ou catégoriser des informations.
• L’IA générative est, quant à elle, conçue pour créer ou générer de nouvelles données en s’appuyant sur celles existantes (par exemple, les modèles de langage comme GPT).
Applications en clinique et en recherche
L’IA est en pleine expansion dans la prise en charge diagnostique, pronostique et thérapeutique des maladies rhumatologiques et des atteintes musculosquelettiques (5, 6).
Aide au diagnostic
Aider au diagnostic
L’analyse automatisée des images médicales et l’exploitation des données cliniques permettent une aide diagnostique. Les réseaux neuronaux convolutifs (CNN) sont particulièrement utiles pour détecter et classer des anomalies en imagerie (radiographie, scanner ou IRM), avec une précision identique, voire supérieure, à celle de l’humain.
• Parmi les nombreuses publications dans la polyarthrite rhumatoïde (PR), Murakami et al. ont développé un modèle par CNN atteignant une sensibilité de 80,5 % et une spécificité de 99 % dans l’identification des érosions sur des radiographies de mains (7).
• Dans une étude sur la gonarthrose, les auteurs ont développé une méthode automatique pour prédire les scores de Kellgren et Lawrence (KL) et d’OARSI à partir de radiographies du genou, avec des résultats prometteurs (coefficient kappa de Cohen de 0,82 pour le score KL et une aire sous la courbe ROC de 0,98) (8).
• Dans l’ostéoporose, une méta-analyse a comparé les performances diagnostiques de l’IA et des cliniciens dans la détection des fractures (42 études, 55 061 ima-ges), montrant une sensibilité et une spécificité de l’IA comparables à celles des cliniciens, tant pour les radiographies que pour les scanners (9).
Accélérer le diagnostic
Des méthodes automatisées fondées sur l’IA permettent d’accélérer le diagnostic, par exemple en visant à quantifier les signaux inflammatoires en IRM dans la PR.
• Un modèle d’IA, entraîné sur 27 phases d’IRM, a montré une forte corrélation avec les évaluations manuelles, avec une performance optimale atteinte en seulement 15 phases (temps d’acquisition de 2,5 minutes). Cette approche a permis une détection précise de la synovite tout en réduisant considérablement le temps d’examen (10).
L’IA offre la possibilité de réorganiser la répartition des tâches du clinicien ou du radiologue, avec du temps économisé qui pourrait être réaffecté à d’autres activités cliniques.
Établir des diagnostics différentiels
L’IA permet également d’établir des diagnostics différentiels en intégrant des données cliniques et biologiques complexes.
• Par exemple, une étude s’est penchée sur l’aide de l’IA dans la distinction entre lupus érythémateux systémique et la maladie de Sjögren à partir de données génétiques et de méthylation, en mettant en évidence des biomarqueurs qui optimisent la classification (11).
• Vera Cruz et al. se sont intéressés quant à eux à l’application de l’IA (forêts aléatoires et régression logistique) pour évaluer l’influence de 20 variables psychologiques et sociales sur la prédiction de deux classes de maladies rhumatismales (inflammatoires versus fibromyalgie). Sur cette thématique, les résultats ne sont pas pour l’instant plus discriminants qu’un interrogatoire classique (12).
Pronostic et suivi des pathologies
L’IA permet une aide dans le pronostic et le suivi des pathologies rhumatologiques.
Anticiper la progression
Des modèles de machine learning permettent d’anticiper la progression de la PR en intégrant des biomarqueurs sériques, des paramètres cliniques et des données d’imagerie (13). Ces outils sont capables d’identifier les patients à risque d’évolution rapide, permettant une adaptation précoce des stratégies thérapeutiques et une personnalisation des traitements.
Suivre les lésions
L’IA peut aussi être utilisée pour le suivi des lésions articulaires (érosions, pincements) via l’analyse d’imageries médicales. Les CNN appliqués à l’IRM et aux radiographies permettent de détecter des changements subtils dans l’érosion osseuse ou l’inflammation synoviale (5).
Estimer le risque
Dans le domaine de l’ostéoporose, des modèles prédictifs fondés sur la densitométrie osseuse sont désormais capables d’estimer le risque fracturaire avec plus de précision que les scores cliniques classiques, comme l’ont démontré Kothari et al. (14).
Une revue systématique a évalué l’IA dans plusieurs domaines clés (évaluation des propriétés osseuses, classification, détection de fractures, prédiction du risque) complétés par le soutien à la décision clinique (15). Malgré des disparités méthodologiques, les études démontrent le potentiel de l’IA pour améliorer le diagnostic précoce et la prise en charge de l’ostéoporose (16).
Suivre les patients
Le suivi des patients peut être optimisé via l’utilisation de trackers d’activité connectés et associés à l’IA, comme le suivi de l’activité physique des patients atteints de maladies rhumatismales (17). L’étude ActConnect a démontré leur efficacité pour détecter les poussées inflammatoires chez les patients atteints de RIC (18). Nous pouvons citer une étude ayant développé un modèle prédictif d’IA performant, utilisant la méthode XGBoost, dans l’objectif d’anticiper les risques de rechute rénale chez des patients atteints de néphrite lupique en rémission (19).
Éducation thérapeutique des patients
L’intégration de l’IA favorise l’autogestion des patients grâce à des chatbots et à des applications mobiles qui offrent des informations personnalisées et un suivi en temps réel des symptômes (20). Des robots éducatifs, tels que ceux du projet ROB’EDUC, robots humanoïdes intervenant au lit des patients hospitalisés pour une poussée d’insuffisance cardiaque, dispensent des programmes thérapeutiques adaptés aux patients hospitalisés (21).
Ces innovations pourraient être étendues en rhumatologie et à l’ostéoporose par exemple, notamment pour optimiser la prise en charge après une fracture et augmenter la couverture de traitement antiostéoporotique.
Applications dans la recherche ou l’enseignement
Optimisation des essais cliniques
L’IA est également une assistance dans la conception et la réalisation des essais cliniques, par exemple pour stratifier les patients en groupes homogènes selon leur profil clinique et génétique. Face aux défis spécifiques posés par les interventions impliquant l’IA, des recommandations spécifiques ont été rédigées (SPIRIT-AI et CONSORT-AI), afin d’encadrer la mise en œuvre des essais cliniques (22, 23). Elles introduisent de nouveaux critères, tels que la description détaillée de l’intervention d’IA, les compétences nécessaires à son utilisation, la gestion des données d’entrée et de sortie, ainsi que l’analyse des erreurs. Les objectifs étant de garantir la transparence, de faciliter l’évaluation critique et de limiter les risques de biais dans les essais cliniques.
Synthèse et gestion des données scientifiques
L’IA facilite la synthèse automatisée de la littérature scientifique, aidant les médecins à traiter rapidement un volume croissant de publications. S’il était encore possible, il y a une dizaine d’années, de se tenir à jour des publications, on sait maintenant qu’il faudrait consacrer 40 ans à temps plein si nous voulions lire l’ensemble des articles médicaux publiés en 2024 !
Autant dire, mission impossible. Il existe actuellement un certain nombre d’outils permettant de réaliser des synthèses automatisées de littérature scientifique, avec possiblement des suggestions d’articles en rapport. Certains algorithmes avancés permettent même d’effectuer automatiquement des méta-analyses en extrayant des résultats quantitatifs (par exemple des tailles d’effet, des intervalles de confiance) directement des publications.
Les avantages sont nombreux : accélération du processus de revue de littérature, réduction des biais de sélection grâce à des recherches exhaustives, identification de liens interdisciplinaires non soupçonnés. Cependant, plusieurs limites subsistent, notamment le risque de biais algorithmique lié aux données d’entraînement et les difficultés à interpréter des concepts trop spécifiques ou ambigus.
Enseignement et formation
Les générateurs d’images fondés sur l’IA produisent des cas interactifs enrichissant la formation des professionnels de santé. Certaines plateformes proposent des simulateurs de patients virtuels pour créer des scénarios cliniques réalistes et s’entraîner en conditions simulées (24). L’IA est une aide précieuse dans la conception des supports de présentations (cours, congrès, illustrations d’articles scientifiques) avec divers choix de design.
Limites et précautions dans l’utilisation de l’IA
L’utilisation de l’IA en médecine n’est pas sans risque, et il existe des limites à connaître et à prendre en considération (Fig. 2).
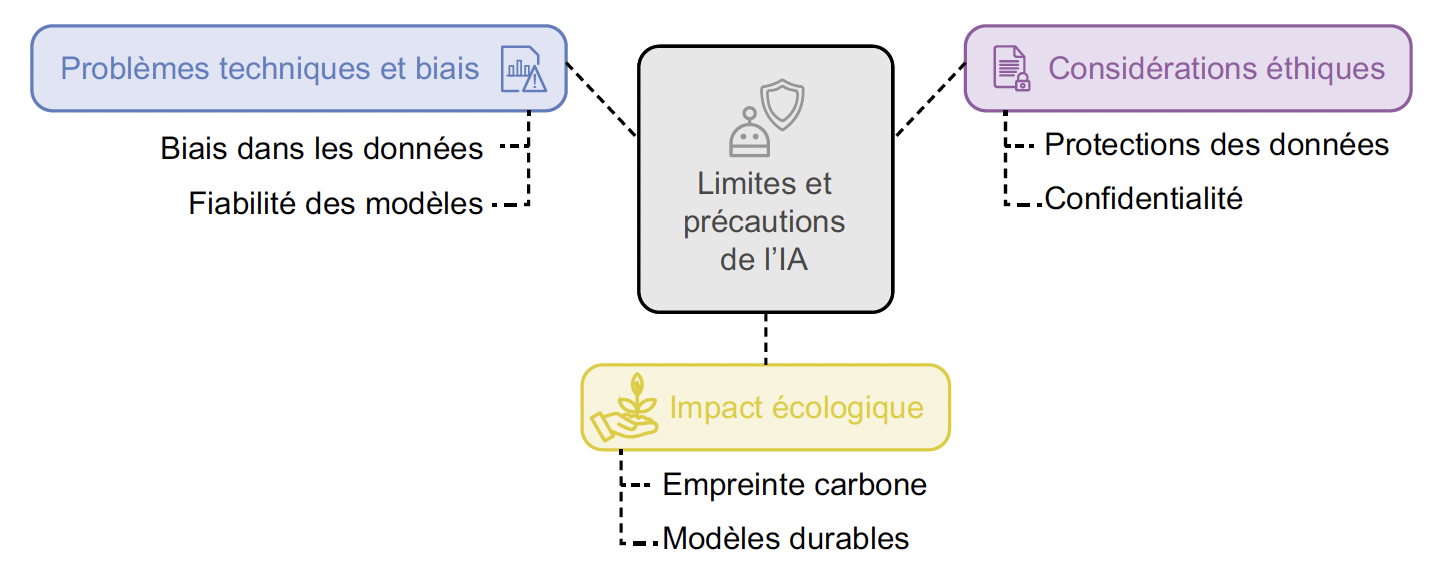
Figure 2 – Schéma des principales limites de l’application de l’IA.
Problèmes techniques et biais
Biais dans les bases de données d’entraînement
L’un des défis majeurs dans l’utilisation de l’IA en rhumatologie est la présence de biais dans les bases de données d’entraînement. En effet, plusieurs études ont montré que les modèles peuvent être biaisés par une surreprésentation de certains profils de patients. Les bases de données utilisées en rhumatologie ou dans d’autres spécialités contiennent souvent des déséquilibres démographiques, notamment une surreprésentation des patients d’origine européenne (5).
Fiabilité dans les cas atypiques ou non standardisés
Les problèmes de fiabilité des modèles d’IA sont également préoccupants dans des cas atypiques ou non standardisés. L’une des difficultés rencontrées par les modèles de deep learning réside dans l’interprétation des images médicales inhabituelles ou présentant des artefacts non représentés dans les données d’entraînement (25, 26). La complexité des techniques de deep learning engendre parfois une opacité, souvent qualifiée de “boîte noire”, qui rend difficile l’interprétation des décisions par les professionnels de santé.
Fiabilité dans la recherche bibliographique
Enfin, il existe une franche limite de l’utilisation de l’IA dans la recherche bibliographique à l’heure actuelle avec un manque de fiabilité. Les réponses des IA lors de l’analyse de la littérature par les différents outils se fondent à la fois sur des abstracts et sur des articles disponibles en open access, et l’absence de distinction des deux ne permet pas une analyse rigoureuse. La recherche de liens et d’articles se fait essentiellement par rapport aux articles cités par l’article source.
L’outil idéal serait celui qui saurait répondre à une question en langage naturel et sourcerait ses infos tout en proposant une classification des articles selon la robustesse des auteurs et du journal dans lequel l’article a été publié.
Considérations éthiques
Les considérations éthiques restent un enjeu central de l’intégration de l’IA en médecine. La protection des données médicales sensibles est une préoccupation majeure. Les données utilisées pour entraîner les algorithmes doivent être rigoureusement anonymisées afin de respecter les normes de confidentialité, selon les recommandations éthiques en vigueur sur les données de santé. L’utilisation des dossiers médicaux électroniques (DME), source presque infinie de recherche, soulève des risques d’atteinte à la vie privée, malgré les avantages offerts en termes de prédiction de l’évolution des maladies ou de diagnostic anticipé. On peut citer une étude qui a développé un modèle d’apprentissage automatique à partir de DME longitudinaux de 161 584 patients, afin d’identifier les individus nécessitant une évaluation rhumatologique. Le modèle a montré de hautes performances prédictives, détectant des besoins en tests d’auto-anticorps et en consultations spécialisées jusqu’à 5 ans avant la date de diagnostic, surpassant les standards cliniques actuels et offrant une approche prometteuse pour systématiser et accélérer le dépistage des maladies auto-immunes (27). Se pose ici la question du caractère interventionnel et invasif (ressources, coûts) si l’on venait à déployer ce type d’outils sur les données patient du DME.
Impact écologique
L’impact environnemental des technologies d’IA est plutôt ambivalent. S’il est indéniable que l’IA a des effets positifs (contribution dans la lutte contre le changement climatique, optimisation des réseaux énergétiques, développement d’infrastructures à faible émission), ses aspects négatifs sont également une source croissante de préoccupations (28). En effet, les modèles de deep learning génèrent d’importants taux d’émission de CO2. Cette empreinte énergétique provient essentiellement de la consommation énergétique massive des centres de données, notamment ceux utilisant des CNN ou des transformateurs (4).
Par conséquent, il devient nécessaire de développer des modèles d’IA plus durables et optimisés pour réduire leur consommation énergétique. L’utilisation de techniques d’apprentissage fédéré et de modèles allégés pourrait limiter cet impact tout en conservant une efficacité élevée.
Un changement de pratique nécessaire
L’utilisation de l’IA dans la pratique rhumatologique impose un changement d’habitudes dans le raisonnement. En cas de sollicitation de l’IA pour évoquer des hypothèses diagnostiques, il faut être particulièrement exhaustif et s’attacher à la qualité du prompt en énumérant l’ensemble des paramètres anamnestiques, cliniques et résultats complémentaires. Cette méthodologie diffère du raisonnement hypothético-déductif que nous utilisons en pratique courante. Il faut garder en tête que pour obtenir des réponses fiables (prenons l’exemple de Chat-GPT), il faut savoir rédiger un prompt de qualité, sans omettre les éléments importants et cela prend du temps. Le clinicien doit être également capable de critiquer les résultats proposés, ce qui peut se révéler plus difficile en début de formation.
En conclusion de cette partie théorique, une approche équilibrée associant l’expertise humaine aux capacités de l’IA est nécessaire, afin d’optimiser les bénéfices tout en minimisant les risques de ces outils.
Applications pratiques pour les rhumatologues : la boîte à outils !
Les rhumatologues bénéficient d’une panoplie d’outils assistés par l’IA pour améliorer leur pratique clinique, leurs apprentissages, les missions d’enseignement ou encore les tâches administratives (Fig. 3). Si ChatGPT est bien connu de tous, il existe bon nombre d’autres outils qui méritent d’être connus et utilisés.
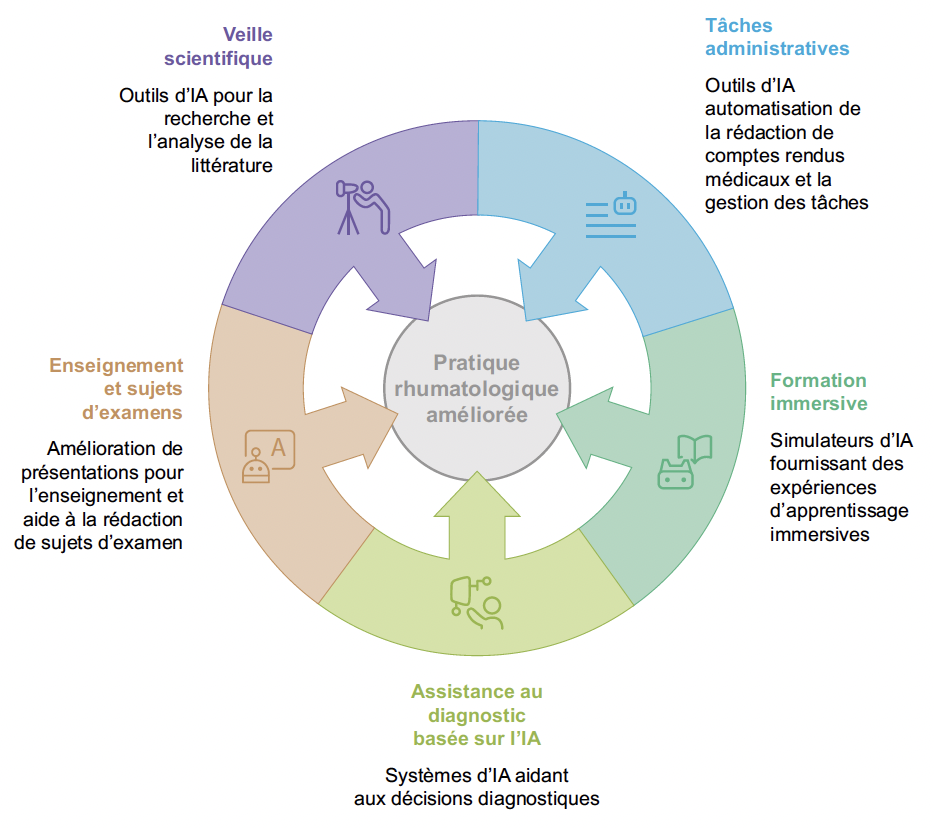
Figure 3 – Intégration de l’IA dans la pratique rhumatologique.
Cette partie est une boîte à outils avec des suggestions d’applications pour la pratique du rhumatologue en vue d’une intégration efficace de l’IA dans son quotidien professionnel. Ces listes sont loin d’être exhaustives et leurs citations ne relèvent d’aucun parti pris de l’auteur.
Tâches administratives
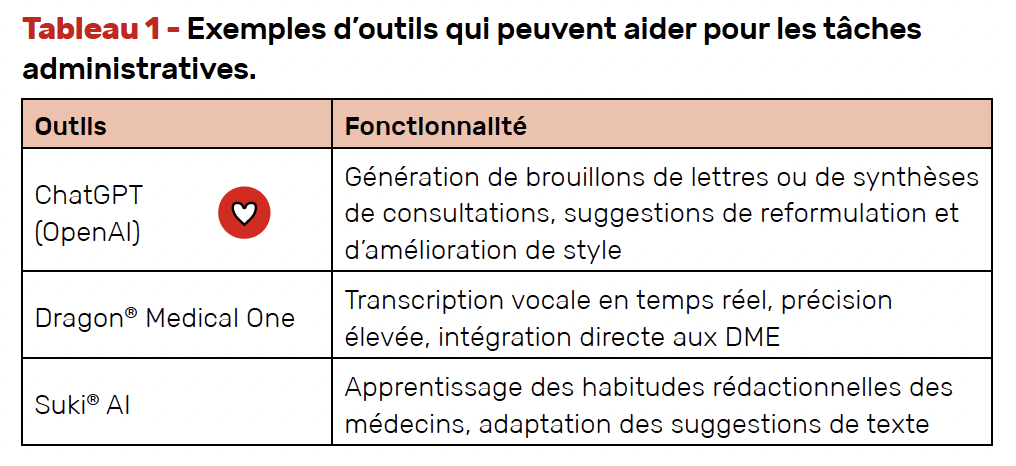
Les tâches administratives prennent un temps non négligeable dans les activités quotidiennes, et ce, que l’on soit interne, jeune ou ancien rhumatologue, en libéral ou en exercice hospitalier. Des outils d’IA permettent de générer automatiquement des lettres de consultation, des comptes rendus d’hospitalisation et des résumés de dossiers médicaux, réduisant ainsi la charge administrative. Le tableau 1 présente quelques exemples d’outils qui peuvent aider.
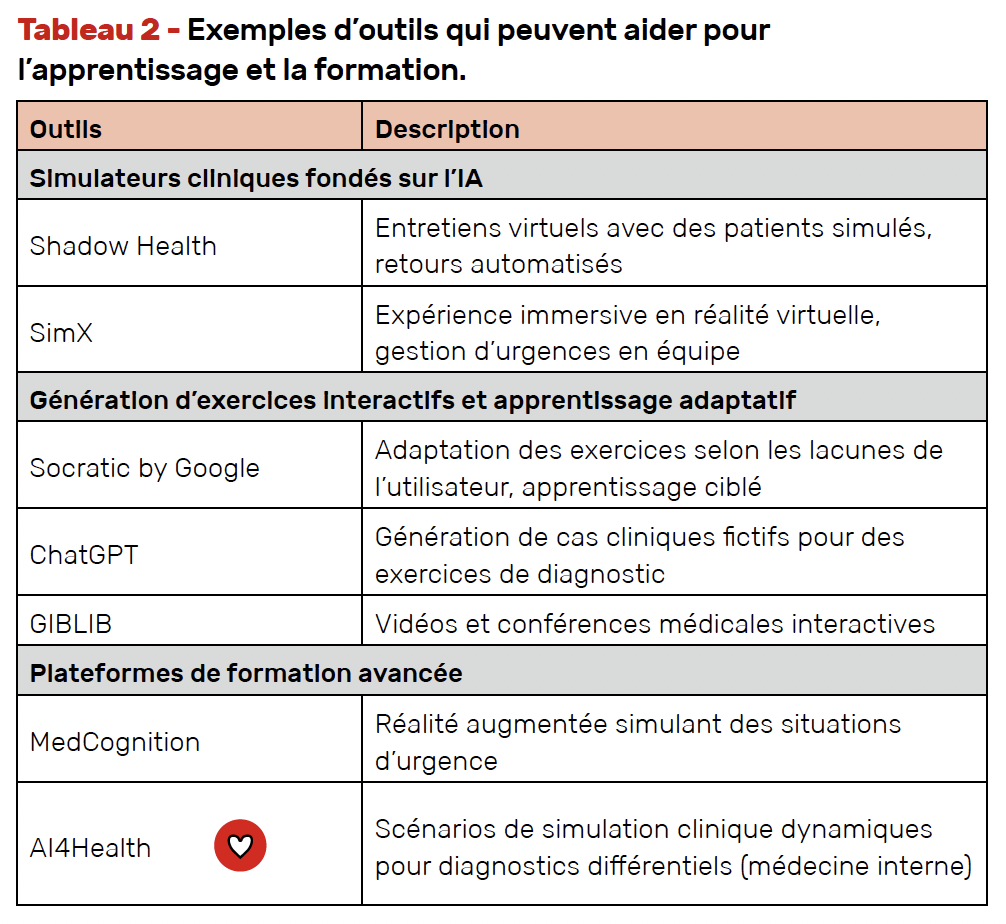
Apprentissage et formation
Les simulateurs d’IA offrent aux étudiants, internes, jeunes praticiens, la possibilité de s’exercer sur des cas cliniques au plus près de la réalité et changer de l’apprentissage classique dans les livres (Tab. 2).
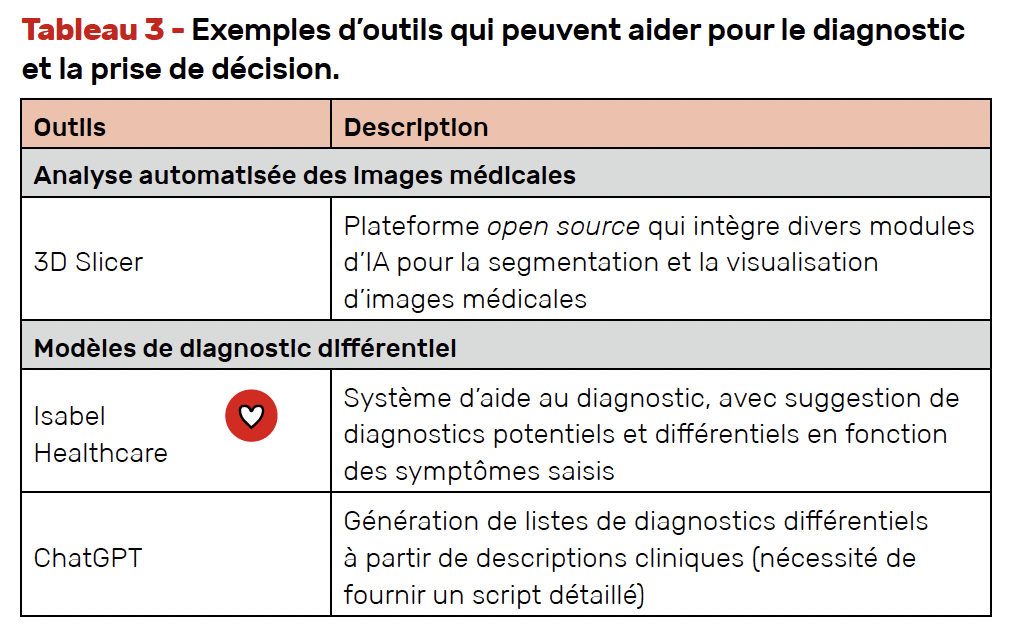
Assistance au diagnostic et à la prise de décision
Quelques exemples d’outils qui peuvent aider sont présentés dans le tableau 3.
Facilitation de l’enseignement
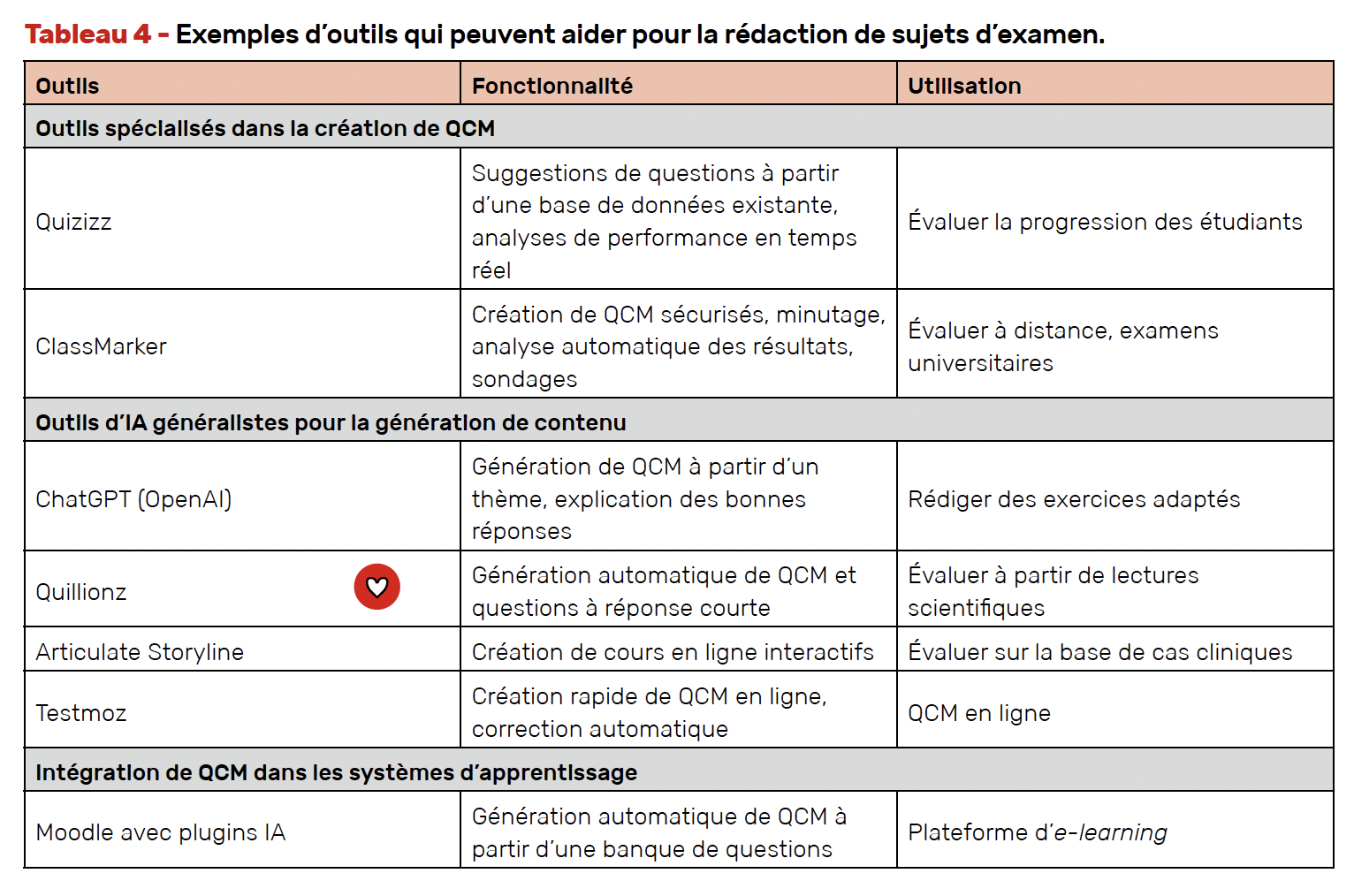
Rédaction de sujets d’examen
De nombreux outils d’IA peuvent aider les rhumatologues à rédiger des QCM. Ces outils facilitent la génération automatique de questions, selon le format souhaité, l’adaptation au niveau des étudiants et la vérification des connaissances (Tab. 4).
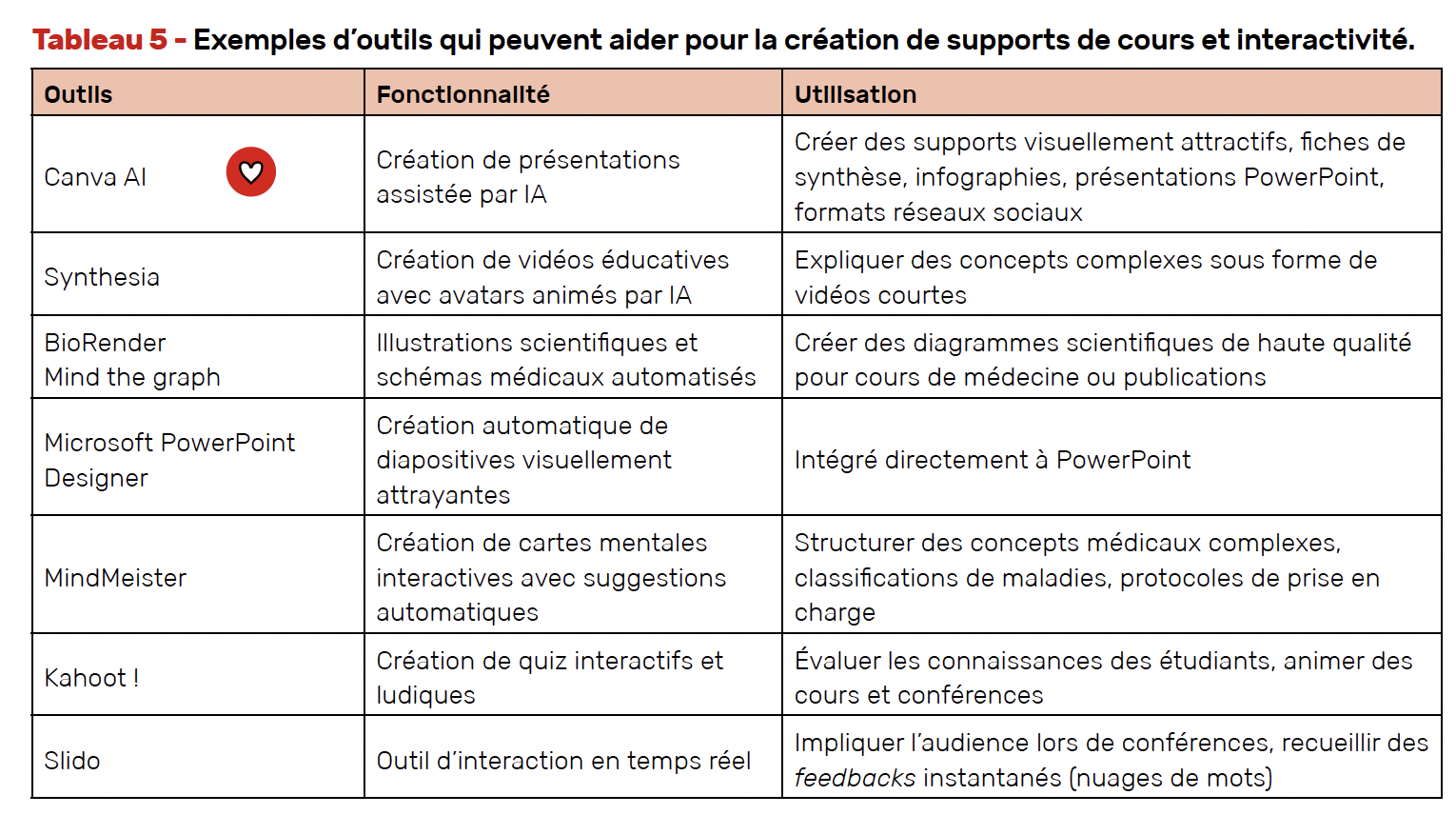
Création de supports de cours et interactivité
Ces outils permettent aux enseignants de médecine d’améliorer la qualité pédagogique des supports et de proposer des contenus interactifs adaptés, tout en gagnant du temps (Tab. 5).
Veille scientifique et correction d’articles
Les publications scientifiques sont abondantes et il devient difficile de s’y retrouver et de se tenir à jour. Les outils de gestion de bibliographie et de veille scientifique sont une aide substantielle dans cet exercice de mise à jour des connaissances récemment publiées (cf. limitations décrites plus haut). Voici une petite sélection :
Veille scientifique
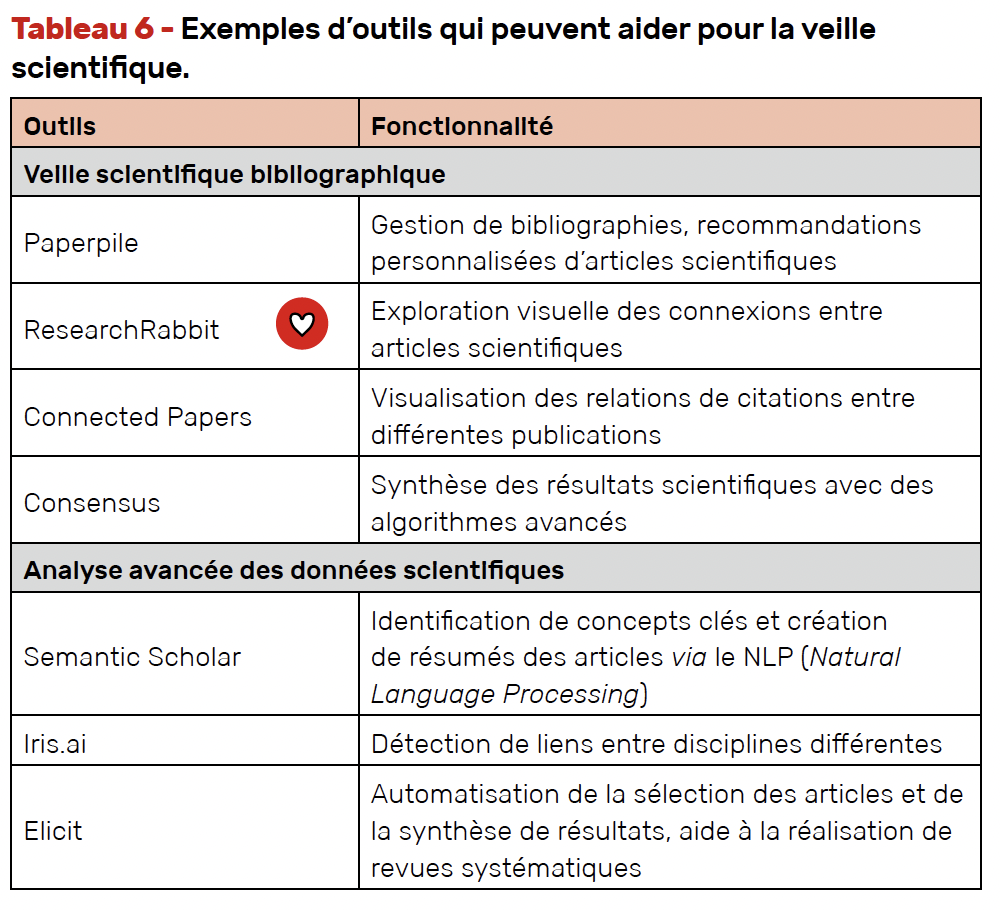
Le tableau 6 propose quelques outils d’aide à la veille scientifique.
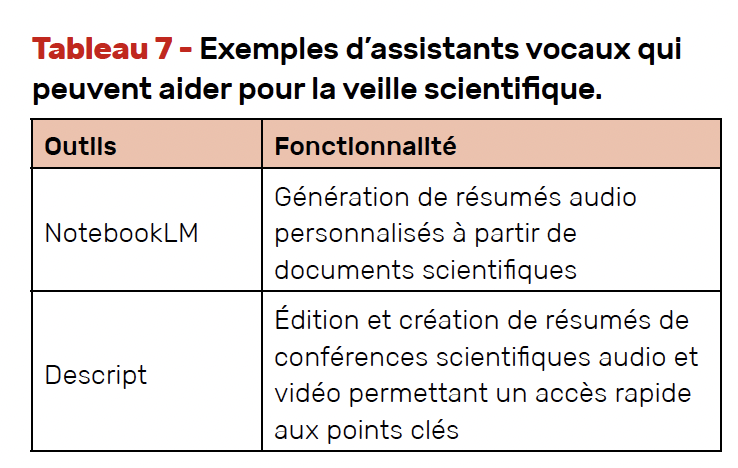
Alimentés par l’IA, des assistants vocaux sont en cours de développement pour aider les chercheurs à se tenir informés des dernières études tout en effectuant d’autres tâches (Tab. 7).
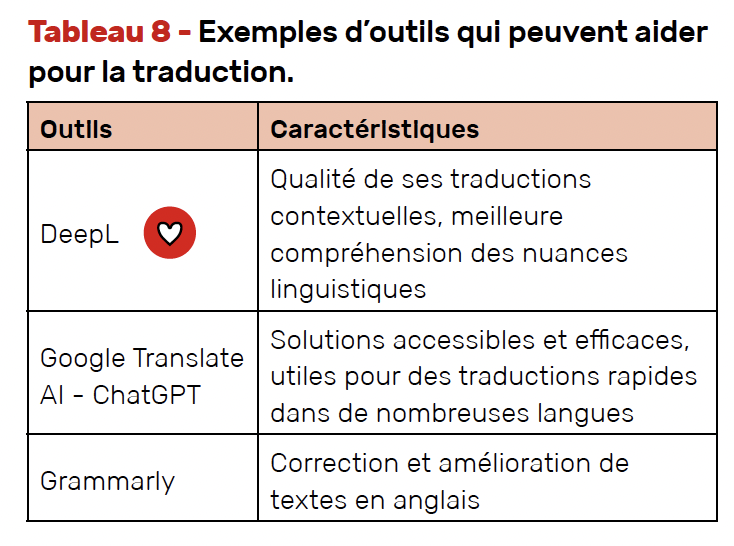
Aide à la traduction
Que ce soit pour la rédaction d’articles scientifiques, la préparation de communications orales ou posters à un congrès, la maîtrise de l’anglais est nécessaire. Des applications utilisant l’IA sont disponibles pour aider dans cette tâche (Tab. 8).

L’auteur déclare ne pas avoir de liens d’intérêt en rapport avec cet article.
Bibliographie
1. Beam AL, Drazen JM, Kohane IS et al. Artificial intelligence in medicine. N Engl J Med 2023 ; 388 : 1220-1.
2. Lotter W, Hassett MJ, Schultz N et al. Artificial intelligence in oncology: current landscape, challenges, and future directions. Cancer Discov 2024 ; 14 : 711-26.
3. Syed AB, Zoga AC. Artificial Intelligence in radiology: current technology and future directions. Semin Musculoskelet Radiol 2018 ; 22 : 540-5.
4. Sequí-Sabater JM, Benavent D. Artificial intelligence in rheumatology research: what is it good for? RMD Open 2025 ; 11 : e004309.
5. Madrid-García A, Merino-Barbancho B, Rodríguez-González A et al. Understanding the role and adoption of artificial intelligence techniques in rheumatology research: An in-depth review of the literature. Semin Arthritis Rheum 2023 ; 61 : 152213.
6. McMaster C, Bird A, Liew DFL et al. Artificial intelligence and deep learning for rheumatologists. Arthritis Rheumatol 2022 ; 74 : 1893-905.
7. Murakami S, Hatano K, Tan J et al. Automatic identification of bone erosions in rheumatoid arthritis from hand radiographs based on deep convolutional neural network. Multimed Tools Appl 2018 ; 77 : 10921-37.
8. Tiulpin A, Saarakkala S. Automatic grading of individual knee osteoarthritis features in plain radiographs using deep convolutional neural networks. Diagnostics 2020 ; 10 : 932.
9. Kuo RYL, Harrison C, Curran T-A et al. Artificial intelligence in fracture detection: a systematic review and meta-analysis. Radiology 2022 ; 304 : 50-62.
10. Mao Y, Imahori K, Fang W et al. Artificial intelligence quantification of enhanced synovium throughout the entire hand in rheumatoid arthritis on dynamic contrast-enhanced MRI. J Magn Reson Imaging 2025 ; 61 : 771-83.
11. Martorell-Marugán J, Chierici M, Jurman G et al. Differential diagnosis of systemic lupus erythematosus and Sjögren’s syndrome using machine learning and multi-omics data. Comput Biol Med 2023 ; 152 : 106373.
12. Vera Cruz G, Bucourt E, Réveillère C et al. Machine learning reveals the most important psychological and social variables predicting the differential diagnosis of rheumatic and musculoskeletal diseases. Rheumatol Int 2022 ; 42 : 1053-62.
13. Kedra J, Radstake T, Pandit A et al. Current status of use of big data and artificial intelligence in RMDs: a systematic literature review informing EULAR recommendations. RMD Open 2019 ; 5 : e001004.
14. Kothari S, Gionfrida L, Bharath AA et al. Artificial Intelligence (AI) and rheumatology: a potential partnership. Rheumatology 2019 ; 58 : 1894-5.
15. Gatineau G, Shevroja E, Vendrami C et al. Development and reporting of artificial intelligence in osteoporosis management. J Bone Miner Res 2024 ; 39 : 1553-73.
16. Lee C, Joo G, Shin S et al. Prediction of osteoporosis in patients with rheumatoid arthritis using machine learning. Sci Rep 2023 ; 13 : 21800.
17. Davergne T, Kedra J, Gossec L. Wearable activity trackers and artificial intelligence in the management of rheumatic diseases: Where are we in 2021? Z Rheumatol 2021 ; 80 : 928-35.
18. Jacquemin C, Molto A, Servy H et al. Flares assessed weekly in patients with rheumatoid arthritis or axial spondyloarthritis and relationship with physical activity measured using a connected activity tracker: a 3-month study. RMD Open 2017 ; 3 : e000434.
19. Chen Y, Huang S, Chen T et al. Machine learning for prediction and risk stratification of lupus nephritis renal flare. Am J Nephrol 2021 ; 52 : 152-60.
20. IBM Newsroom. Arthritis Research UK Introduces IBM Watson-Powered ‘Virtual Assistant’ to Provide Information and Advice to People with Arthritis. IBM UK Newsroom. 14 mars 2017. Disponible sur : uk.newsroom.ibm.com/2017-03-14-Arthritis-Research-UK-Introduces-IBM-Watson-Powered-Virtual-Assistant-to-Provide-Information-and-Advice-to-People-with-Arthritis.
21. Chanrond A. ROB’EDUC : l’intelligence artificielle pour l’éducation thérapeutique. ICAN 2022. Disponible sur : ihuican.org/robeduc-lintelligence-artificielle-au-service-de-leducation-therapeutique/.
22. Rivera SC, Liu X, Chan A-W et al. Guidelines for clinical trial protocols for interventions involving artificial intelligence: the SPIRIT-AI Extension. BMJ 2020 ; 370 : m3210.
23. Liu X, Rivera SC, Moher D et al. Reporting guidelines for clinical trial reports for interventions involving artificial intelligence: the CONSORT-AI Extension. BMJ 2020 ; 370 : m3164.
24. Body Interact – Virtual Patients Simulator. 2019. Disponible sur : bodyinteract.com/.
25. Stoel B. Use of artificial intelligence in imaging in rheumatology – current status and future perspectives. RMD Open 2020 ; 6 : e001063.
26. Stoel BC, Staring M, Reijnierse M et al. Deep learning in rheumatological image interpretation. Nat Rev Rheumatol 2024 ; 20 : 182-95.
27. Forrest IS, Petrazzini BO, Duffy Á et al. A machine learning model identifies patients in need of autoimmune disease testing using electronic health records. Nat Commun 2023 ; 14 : 2385.
28. Shan T, Feng S, Li K et al. Unveiling the effects of artificial intelligence and green technology convergence on carbon emissions: An explainable machine learning-based approach. J Environ Manage 2025 ; 373 : 123657.




