Les injections de plasma riche en plaquettes (PRP) sont de plus en plus proposées aux patients atteints de gonarthrose bien que les sociétés savantes ne les recommandent pas ou ne statuent pas sur leur utilisation du fait d’un manque de données scientifiques suffisamment robustes. Cette mise au point expose les mécanismes d’action connus des PRP et les résultats d’essais cliniques récents, positifs et négatifs, afin de mieux appréhender la place de ce traitement. Les différences avec la pratique courante sont discutées.
Introduction
L’arthrose est de très loin la pathologie articulaire la plus fréquente, source de douleur et d’un handicap fonctionnel parfois majeur. Le genou en est la principale localisation aux membres inférieurs.
Les traitements médicaux
Selon les dernières recommandations de la Société française de rhumatologie (SFR) de 2020, le traitement de la gonarthrose repose sur l’association à la fois des traitements symptomatiques per os ou topiques, des injections intra-articulaires de corticostéroïdes ou d’acides hyaluroniques (AH) et à la fois des traitements non pharmacologiques comme la rééducation, l’activité physique, les orthèses, l’éducation thérapeutique… (1).
Malgré cela, un certain nombre de patients restent douloureux et gênés dans leurs activités quotidiennes ou sportives. En effet, les traitements oraux sont souvent peu efficaces (paracétamol) et/ou associés à des effets indésirables (anti-inflammatoires non stéroïdiens (AINS)) tandis que les injections intra-articulaires sont d’efficacité variable et souvent partielle.
La prothèse totale de genou
En cas de persistance des symptômes malgré un traitement médical optimal, et d’un stade radiographique avancé, une prothèse totale de genou (PTG) peut être proposée. Les résultats de la PTG sont satisfaisants dans la plupart des cas. Cependant, il existe des risques opératoires infectieux et thrombo-emboliques, d’autant plus fréquents que le patient est âgé et présente des comorbidités (obésité notamment). De plus, il est décrit des douleurs chroniques après une PTG dans 20 % des cas (2) tandis que le délai avant reprise chirurgicale est de 25 ans dans 82 % des cas (3).
L’important est donc de proposer cette PTG au bon moment, pas trop tôt, afin d’éviter la reprise chirurgicale et pas trop tard, afin d’éviter d’accumuler des comorbidités.
Les injections de PRP
Il y a donc besoin de traitements nouveaux dans la gonarthrose pour aider à soulager les patients chez qui une PTG n’est pas envisagée.
Les injections de plasma riche en plaquettes (PRP) font partie des traitements innovants développés depuis quelques années dans la gonarthrose. Néanmoins, les sociétés savantes comme la SFR en 2020, l’American College of Rheumatology (ACR) ou l’OsteoArthritis Research Society International (OARSI) soulignaient l’absence de données suffisamment solides et un manque de standardisation pour pouvoir les recommander, quand bien même, ils sont de plus en plus utilisés en pratique (1, 4, 5).
Les données scientifiques sont désormais plus nombreuses, mais le sujet reste controversé du fait de l’hétérogénéité des résultats des études récentes. Le coût important pour le patient, dû au besoin matériel et humain et à la non prise en charge par la CPAM, en est une autre limite (6).
Cette revue vise à exposer les données pertinentes physiologiques et les essais cliniques marquants afin de mieux appréhender la place de ce traitement.
Physiopathologie de l’arthrose
L’arthrose est caractérisée par une dégradation du cartilage, mais aussi des autres tissus de l’articulation (membrane synoviale, os sous-chondral…). Au sein du cartilage, il existe une modification du phénotype et, plus tardivement, une diminution du nombre de chondrocytes ainsi qu’une altération de la matrice extra-cellulaire, du fait d’un excès des facteurs pro-dégradatifs au détriment des médiateurs anaboliques. Ce déséquilibre est favorisé, entre autres, par l’induction d’un phénotype inflammatoire des chondrocytes. La membrane synoviale est également activée par des débris cartilagineux et devient hyperplasique. Les cellules de l’immunité qui y sont recrutées relarguent des cytokines pro-inflammatoires comme l’IL-1 ou l’IL-6, des chimiokines et des protéases qui vont favoriser à leur tour la dégradation du cartilage, engendrant ainsi un cercle vicieux.
Mécanismes d’action des PRP
Le PRP est un traitement autologue dérivé du sang. Il s’agit d’un traitement orthobiologique, c’est-à-dire une approche ayant pour objectif de préserver les tissus en modulant le microenvironnement pathologique. À ce titre, il fait partie des thérapies dites régénératives.
Il est obtenu après centrifugation d’un tube de sang total issu du patient lui-même. Le concentré plaquettaire obtenu est un produit riche en facteurs de croissance (PDGF, TGF, FGF…) et autres molécules bioactives libérées par les plaquettes (MMPs, IL-4, IL-10, IL-1, IL-6…), qui va pouvoir interagir avec les tissus impliqués dans l’arthrose, mais son mode d’action reste complexe et non encore totalement élucidé.
Les données fondamentales tendent à mettre en évidence un effet chondroprotecteur, comme la prévention de l’apoptose des chondrocytes, la diminution du catabolisme et l’augmentation de l’anabolisme de la matrice extra-cellulaire, mais également un effet anti-inflammatoire au niveau de la synoviale via notamment une possible inhibition de la voie NFKb (7, 8).
Les études cliniques récentes
Les méta-analyses
Une soixantaine de méta-analyses a déjà été réalisée sur ce sujet ! L’une d’entre elles, de bonne qualité méthodologique, a été publiée en 2023 : les données de 40 essais randomisés contrôlés (ERC), ayant comparé les PRP aux AH, aux corticostéroïdes ou au placebo, ont été analysées. La qualité des essais inclus et les protocoles utilisés étaient très variables.
En poolant les données des scores douleur, l’effet du PRP était statistiquement supérieur à celui de l’AH à la fois entre 1 et 6 mois et après 6 mois (mais ne l’était pas dans le premier mois). Les scores fonctionnels étaient également statistiquement meilleurs avec le PRP qu’avec l’AH à tous les temps. Néanmoins, il n’y avait plus de différence statistique entre PRP et AH après exclusion des essais de moins bonne qualité. Le PRP était supérieur au placebo pour l’amélioration de la douleur à moyen terme et de la fonction à moyen et long termes, sur la base de sept ERC (9).
Les essais contrôlés randomisés
Ces 5 dernières années, plus d’une quinzaine d’ERC ont été publiés dans la gonarthrose, certains avec des résultats au moins en partie positifs (10, 11), d’autres négatifs (12, 13). Dans tous les cas, le PRP avait un bon profil de tolérance.
Les études positives
• Parmi les études positives, l’essai de Chu et al., publié en 2023, était un ERC d’une durée totale de 5 ans, en double aveugle pendant 2 ans, multicentrique comparant un PRP non commercial au placebo (11). Les patients avaient un IMC < 40 kg/m2, une gonalgie unilatérale et une atteinte radiographique modérée selon le score de Kellgren Lawrence (KL) (score KL 1 à 3) ou une atteinte du cartilage en IRM. L’aveugle était respecté et maintenu 2 ans. Trois injections hebdomadaires de 5 ml de PRP, avec une concentration moyenne en plaquettes de 4,3 fois la concentration sérique, étaient comparées à celles de sérum physiologique. 644 patients ont été randomisés.
Les WOMAC total, douleur et fonction diminuaient dans les deux groupes, mais de manière plus importante dans le groupe PRP à tous les temps à partir de 3 mois et jusqu’à 48 mois. À 6 mois, les taux de TNF et d’IL-1 dans le liquide articulaire avaient diminué après les injections de PRP, mais pas après les injections de placebo. Le volume de cartilage en IRM avait diminué dans les deux groupes à 5 ans, mais statistiquement moins dans le groupe PRP (∆ de 1 140 mm3 (-79 ; 1 320) p < 0,001) (11).
• L’ERC conduit par Raeissadat et al., publié en 2021, avait inclus 238 patients atteints de gonarthrose symptomatique de grade KL 2 ou 3 (10). Il avait pour objectif de comparer les injections d’AH, de PRP, de PRGF (solution plus riche en facteurs de croissance) ou d’ozone : trois injections hebdomadaires pour l’AH et l’ozone et deux injections faites à 3 semaines d’intervalle pour le PRP et le PRGF (se faisant avec des seringues masquées).
Il y avait une amélioration dans les quatre groupes, mais le WOMAC total s’améliorait plus à 6 et 12 mois après le PRP par rapport à l’AH. Le score de Lequesne était meilleur après le PRP qu’avec l’AH à 12 mois, mais pas à 6 mois (10).
Les études négatives
• Parmi les études négatives, l’étude RESTORE, publiée dans le JAMA en 2021, avait pour objectif d’évaluer l’efficacité du PRP sur les symptômes et l’atteinte radiologique par rapport au placebo, chez 288 patients avec une EVA > 4 et un score KL 2 ou 3 (13). Il y avait respectivement 43,8 et 36,8 % de patients présentant un épanchement articulaire initialement.
Il n’y a pas eu de différence à 2 ou 12 mois sur le score douleur, ni sur 29 des 31 critères secondaires. Il n’y avait pas non plus de différence à 12 mois sur le volume du cartilage en IRM (13).
• Un autre ERC très récent a été réalisé chez des patients atteints de gonarthrose avec un score KL 1 à 3, et soit une douleur, soit un épanchement. Après randomisation, il s’agissait d’injecter sous contrôle scopique après 1 ml de produit de contraste : 1 ml de triamcinolone ou 6 ml d’AH ou 3 ml de PRP ou aucun produit, quel que soit le phénotype clinique du patient. L’EVA douleur initiale était basse (32,5/100).
Cette étude n’a pas montré de différence d’efficacité symptomatique entre les produits jusqu’à 24 mois de suivi. Mais notons que les quantités injectées étaient variables (et même avec une certaine dilution pour le PRP) et le niveau de douleur probablement trop faible pour voir apparaître une différence (12).
Discordance entre les études cliniques et la pratique courante
Si les résultats des essais de niveau de preuve élevé sont discordants, la satisfaction des patients semble bonne, atteignant 79 % dans une étude ouverte rétrospective (14). Cette différence entre les essais et la pratique pourrait avoir plusieurs explications (Fig. 1).
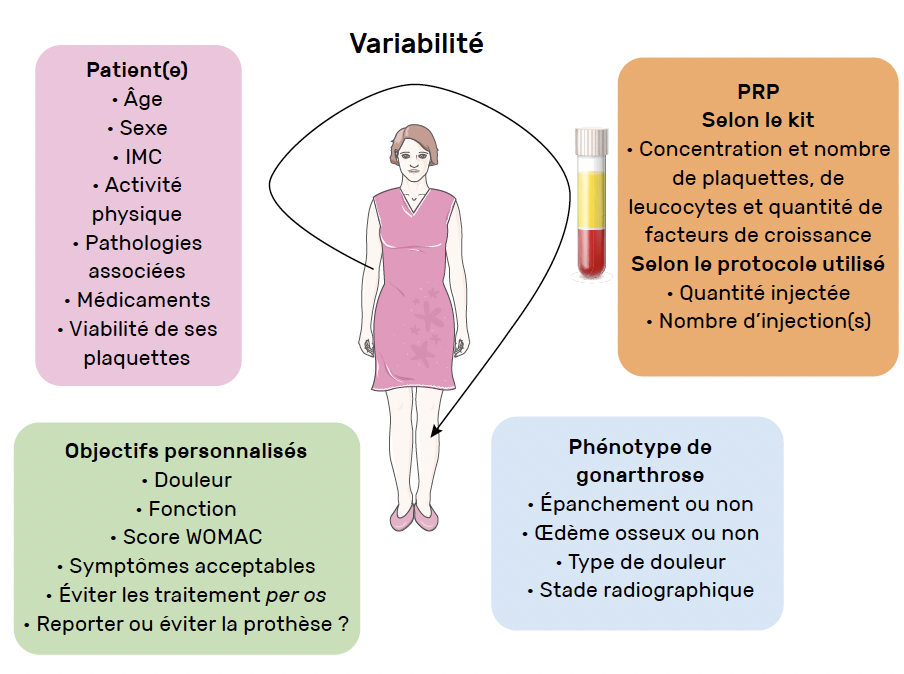
Figure 1 – Facteurs de variabilité dans la pratique d’une injection de PRP.
IMC : indice de masse corporelle ; PRP : plasma riche en plaquettes.
Protocoles d’obtention et composition du PRP
Tout d’abord, il existe une grande hétérogénéité des protocoles d’obtention du PRP. Or la composition du PRP varie en fonction du kit utilisé et des caractéristiques de centrifugation. De même, il existe une variabilité de la composition du PRP en fonction du patient (âge, sexe, activité physique, comorbidités…). Notons toutefois qu’à ce jour la corrélation entre la composition cellulaire (plaquettes, leucocytes) obtenue et l’efficacité clinique reste incertaine (15-17), même s’il avait déjà été décrit qu’une concentration plaquettaire inférieure à 5 N et une concentration faible en leucocytes pouvaient constituer des facteurs prédictifs de meilleurs résultats (18).
Nombre d’injections et volume
Les protocoles des études varient de une à trois injections hebdomadaires à mensuelles et même si trois injections semblent avoir une efficacité plus importante et plus prolongée, le protocole à une injection peut toutefois avoir de bons résultats (19). Enfin, l’importance du volume injecté pourrait également avoir un effet sur l’efficacité clinique comme le suggère une étude récente (20).
Phénotype des patients
Par ailleurs, le phénotype des patients pourrait aussi avoir une incidence sur les résultats. Bien que, conceptuellement, il soit préférable d’injecter le PRP dans un genou sec afin de conserver sa concentration en plaquettes, il semblerait que la présence d’inflammation (épanchement ou synovite) initiale soit associée à une meilleure amélioration de la douleur à court terme (21).
Objectifs
Ensuite, nos objectifs en pratique clinique courante sont souvent adaptés au patient et peuvent différer de ceux des études : ainsi, nous recueillons bien souvent le niveau de douleur et de limitation fonctionnelle, le niveau de symptômes acceptables par le patient et la qualité de vie. On peut aussi se poser la question de la possibilité de report d’une PTG comme objectif sur le long terme. L’étude idéale pour répondre à cette question serait longue et difficile à mettre en place, mais l’équipe de Sanchez et al. a rapporté un report de PTG de plus de 18 mois chez 74,2 % des patients candidats à une PTG qui avaient choisi des injections répétées de PRP intra-articulaires ± intra-osseuses (22).
Effet placebo
Enfin, n’oublions pas que l’effet placebo est important pour l’ensemble des injections intra-articulaires (effet taille de 0,29 (0,04-0,54) similaire à celui du naproxène), ce qui rend la différence d’effet entre PRP et placebo difficile à mettre en évidence. Cet effet placebo ne devrait toutefois pas être négligé par le médecin injecteur de PRP en pratique.
Projets de recherche
• Afin de poursuivre la recherche sur les injections de PRP, l’étude multicentrique PIKOA débutera prochainement dans plusieurs centres en France et permettra de comparer trois injections hebdomadaires de PRP à trois injections de placebo chez les patients souffrant de gonarthrose de stade KL 2 ou 3.
• En parallèle, afin de pouvoir intégrer les éléments de vie réelle pouvant influencer les résultats des injections intra-articulaires, le registre TIAGO vient d’être mis en place : les objectifs sont d’identifier des facteurs prédictifs cliniques et radiographiques de bonne réponse aux injections de corticostéroïdes, d’AH ou de PRP, mais aussi de faire un état des lieux des injections intra-articulaires en France par les rhumatologues, et d’évaluer l’efficacité de ces trois agents thérapeutiques, tout en confirmant leur bonne tolérance. Tous les rhumatologues peuvent y participer en s’inscrivant sur le site de la Fédération des spécialités médicales.
• Par ailleurs, le Groupe de recherche international sur les injections de plaquettes (GRIIP) est une association récemment créée d’experts des thérapies régénératives, et en particulier des PRP, qui travaille sur différents thèmes comme la compréhension des mécanismes d’action, la manière de faire évoluer la recherche dans le domaine, les bonnes pratiques d’utilisation des PRP. Ce groupe a publié en 2021 des recommandations sur l’utilisation des PRP dans la gonarthrose à travers un consensus d’experts (23) : les meilleures indications étaient une gonarthrose symptomatique, plutôt en l’absence d’épanchement et en échec des traitements habituels. Ses contre-indications étaient un cancer actif ou un antécédent récent de cancer, une hémopathie, une infection, une grossesse, une tumeur locale même bénigne comme une synovite villo-nodulaire ou un chondrome (23). Le GRIIP a édité des fiches pratiques disponibles sur www.gripp.org.

Dr Karine Louati déclare ne pas avoir de liens d’intérêt. Pr Florent Eymard déclare avoir un lien d’intérêt avec Regenlab (bourse de recherche) et Fidia (financement pour congrès).
Bibliographie
1. Sellam J, Courties A, Eymard F et al. Recommendations of the French Society of Rheumatology on pharmacological treatment of knee osteoarthritis. Joint Bone Spine 2020 ; 87 : 548‑55.
2. Beswick AD, Wylde V, Gooberman-Hill R et al. What proportion of patients report long-term pain after total hip or knee replacement for osteoarthritis? A systematic review of prospective studies in unselected patients. BMJ Open 2012 ; 2 : e000435.
3. Evans JT, Walker RW, Evans JP et al. How long does a knee replacement last? A systematic review and meta-analysis of case series and national registry reports with more than 15 years of follow-up. Lancet 2019 ; 393 : 655‑63.
4. Kolasinski SL, Neogi T, Hochberg MC et al. 2019 American College of Rheumatology/Arthritis Foundation Guideline for the management of osteoarthritis of the hand, hip, and knee. Arthritis Care Res 2020 ; 72 : 220‑33.
5. McAlindon TE, Bannuru RR, Sullivan MC et al. OARSI guidelines for the non-surgical management of knee osteoarthritis. Osteoarthritis Cartilage 2014 ; 22 : 363‑88.
6. Mass H, Collins J, Hunter D et al. Value of various intr-articular injections for knee osteoarthritis management. ACR Convergence 2023 ; Abstr. 1840.
7. Simental-Mendía M, Ortega-Mata D, Acosta-Olivo CA. Platelet-rich plasma for knee osteoarthritis: what does the evidence say? Drugs Aging 2023 ; 40 : 585‑603.
8. Boffa A, Salerno M, Merli G et al. Platelet-rich plasma injections induce disease-modifying effects in the treatment of osteoarthritis in animal models. Knee Surg Sports Traumatol Arthrosc 2021 ; 29 : 4100‑21.
9. Costa LAV, Lenza M, Irrgang JJ et al. How does platelet-rich plasma compare clinically to other therapies in the treatment of knee osteoarthritis? A systematic review and meta-analysis. Am J Sports Med 2023 ; 51 : 1074‑86.
10. Raeissadat SA, Ghazi Hosseini P, Bahrami MH et al. The comparison effects of intra-articular injection of Platelet Rich Plasma (PRP), Plasma Rich in Growth Factor (PRGF), Hyaluronic Acid (HA), and ozone in knee osteoarthritis; a one year randomized clinical trial. BMC Musculoskelet Disord 2021 ; 22 : 134.
11. Chu J, Duan W, Yu Z et al. Intra-articular injections of platelet-rich plasma decrease pain and improve functional outcomes than sham saline in patients with knee osteoarthritis. Knee Surg Sports Traumatol Arthrosc 2022 ; 30 : 4063‑71.
12. Tschopp M, Pfirrmann CWA, Fucentese SF et al. A randomized trial of intra-articular injection therapy for knee osteoarthritis. Invest Radiol 2023 ; 58 : 355‑62.
13. Bennell KL, Paterson KL, Metcalf BR et al. Effect of intra-articular platelet-rich plasma vs placebo injection on pain and medial tibial cartilage volume in patients with knee osteoarthritis: the RESTORE randomized clinical trial. JAMA 2021 ; 326 : 2021‑30.
14. Alessio-Mazzola M, Lovisolo S, Sonzogni B et al. Clinical outcome and risk factor predictive for failure of autologous PRP injections for low-to-moderate knee osteoarthritis. J Orthop Surg 2021 ; 29 : 23094990211021922.
15. O’Donnell C, Migliore E, Grandi FC et al. Platelet-rich plasma (PRP) from older males with knee osteoarthritis depresses chondrocyte metabolism and upregulates inflammation. J Orthop Res 2019 ; 37 : 1760‑70.
16. Bec C, Rousset A, Brandin T et al. A retrospective analysis of characteristic features of responders and impaired patients to a single injection of pure platelet-rich plasma in knee osteoarthritis. J Clin Med 2021 ; 10 : 1748.
17. Dernek B, Kesiktas FN, Duymus TM et al. Effect of platelet concentration on clinical improvement in treatment of early stage-knee osteoarthritis with platelet-rich plasma concentrations. J Phys Ther Sci 2017 ; 29 : 896‑901.
18. Milants C, Bruyère O, Kaux JF. Responders to platelet-rich plasma in osteoarthritis: a technical analysis. BioMed Res Int 2017 ; 2017 : 7538604.
19. Yurtbay A, Say F, Çinka H, Ersoy A. Multiple platelet-rich plasma injections are superior to single PRP injections or saline in osteoarthritis of the knee: the 2-year results of a randomized, double-blind, placebo-controlled clinical trial. Arch Orthop Trauma Surg 2022 ; 142 : 2755‑68.
20. Patel S, Gahlaut S, Thami T et al. Comparison of conventional dose versus superdose platelet-rich Plasma for knee osteoarthritis: a prospective, triple-blind, randomized clinical trial. Orthop J Sports Med 2024 ; 12 : 23259671241227863.
21. Oo WM, Linklater J, Bennell KL et al. Inflammatory ultrasound features as prognostic factors of pain and functional outcomes following intra-articular platelet-rich plasma in knee osteoarthritis. Int J Rheum Dis 2023 ; 26 : 1540‑6.
22. Sánchez M, Jorquera C, Sánchez P et al. Platelet-rich plasma injections delay the need for knee arthroplasty: a retrospective study and survival analysis. Int Orthop 2021 ; 45 : 401‑10.
23. Eymard F, Ornetti P, Maillet J et al. Intra-articular injections of platelet-rich plasma in symptomatic knee osteoarthritis: a consensus statement from French-speaking experts. Knee Surg Sports Traumatol Arthrosc 2021 ; 29 : 3195‑210.




