Résumé
La stratégie du Treat-to-target (T2T) préconise un suivi rapproché utilisant des outils standardisés, avec pour objectif d’atteindre une cible prédéfinie de rémission ou de faible activité de la maladie. Cette stratégie a fait ses preuves dans la polyarthrite rhumatoïde. Elle est également recommandée dans la spondyloarthrite axiale (axSpA). Mais qu’en est-il des données sous-
jacentes et de la faisabilité de cette stratégie ?
Nous allons voir ici les données récentes portant sur la stratégie T2T dans l’axSpA, en présentant les cibles du traitement, les bénéfices potentiels ainsi que les défis à relever pour la mise en place d’une stratégie T2T en pratique clinique.
Abstract
Is the Treat-to-target applicable to axial spondyloarthritis?
The Treat-to-target (T2T) strategy advocates close follow-up using standardized tools, aiming to reach a predefined target of remission or low disease activity. The advantages of this strategy have been proven in rheumatoid arthritis. It is also recommended in axial spondyloarthritis (axSpA). But what are the underlying data and the feasibility of this strategy?
Here we will review recent data on the T2T strategy in axSpA, outlining treatment targets, potential benefits, and challenges to implementing a T2T strategy in clinical practice.
Introduction
Le concept de Treat-to-Target (T2T) préconise un suivi rapproché utilisant des outils standardisés, avec pour objectif d’atteindre une cible prédéfinie de rémission ou de faible activité de la maladie. Cette stratégie T2T a été initialement développée dans des pathologies chroniques telles que le diabète et l’hypertension. L’objectif est alors d’atteindre des valeurs cibles d’hémoglobine glycosylée (HbA1C) ou de chiffres tensionnels afin de prévenir les complications futures.
Le concept T2T repose tout d’abord sur l’identification d’un élément précis fortement corrélé aux conséquences futures irréversibles. Il doit également inclure un critère d’évaluation de ce facteur avec des preuves qu’au-dessous d’un certain seuil, ces conséquences seront prévenues ou fortement inhibées. Dans le cas du diabète, les études ont démontré que les valeurs élevées de glycémie entraînent à long terme une rétinopathie diabétique et qu’une cible d’HbA1c inférieure à 7 % diminue le risque de survenue de cette complication.
La cible de la stratégie thérapeutique doit également être évaluée de façon régulière et rapprochée, et, lorsqu’elle est atteinte, doit être maintenue au cours du temps. Si la cible thérapeutique n’est pas atteinte, l’approche T2T propose d’intensifier le traitement pour atteindre cet objectif prédéfini.
Le concept du T2T est désormais appliqué en rhumatologie dans la polyarthrite rhumatoïde (PR), la goutte et a été proposé dans le rhumatisme psoriasique (RPso). Cette stratégie T2T a également été recommandée dans la spondyloarthrite axiale (axSpA) dès 2014 (1, 2) et découle de preuves indirectes montrant que l’inhibition du processus inflammatoire dans l’axSpA et un meilleur contrôle de l’activité de la maladie sont associés à l’inhibition des dommages structuraux majeurs (1, 3).
Cependant, des défis persistent concernant cette stratégie et le choix de la cible optimale à atteindre dans l’axSpA.
Nous allons présenter ici les actualités de la stratégie T2T dans l’axSpA, discuter les cibles T2T prédéfinies, puis nous allons nous focaliser sur les preuves actuelles et les controverses liées à cette stratégie.
Quelle est la cible à atteindre dans une stratégie T2T ?
Le choix de la cible
La stratégie T2T dépend du choix d’une cible thérapeutique optimale. Dans les maladies inflammatoires chroniques, en particulier dans la PR, le RPso et l’axSpA, la rémission clinique a été proposée comme la cible optimale à atteindre (1). Cependant, l’axSpA est une maladie hétérogène qui comprend à la fois des éléments cliniques axiaux et périphériques ainsi que des manifestations extra-articulaires, ce qui rend le concept de rémission plus difficile à préciser (4). La rémission clinique est définie comme l’absence de preuve clinique et biologique d’une activité inflammatoire significative de la maladie ce qui peut être compris comme l’absence de manifestations musculosquelettiques (atteinte axiale, mais aussi arthrite, dactylite, enthésite) ou de manifestations extra-articulaires (1). À ce jour, il n’existe pas de consensus clair sur la définition optimale de la rémission (4). Dans les essais cliniques, différents scores composites d’activité de la maladie ont été utilisés pour définir la rémission :
1. Le critère de rémission partielle de l’ASAS (Assessment of spondyloarthritis international society, ASAS-PR) qui est déterminé par un score inférieur à 2 sur une échelle de 0 à 10 pour chacun des quatre domaines : douleur axiale, fonction, évaluation globale du patient (EGP) et inflammation (raideur matinale) (5).
2. Un score bas (habituellement <4/10) de BASDAI (Bath ankylosing spondylitis disease activity index) qui comprend cinq résultats rapportés par les patients (PROs) fondés sur la douleur (axiale, périphérique, enthésitique), la raideur matinale et la fatigue (6).
3. Un score d’ASDAS de maladie inactive (Ankylosing spondylitis disease activity score, ASDAS-ID) qui intègre à la fois des PROs (douleurs axiales et périphériques, raideur matinale, EGP) et des mesures objectives de l’inflammation (protéine C réactive ou vitesse de sédimentation) (6).
En 2017, le groupe de travail international T2T (1) a mis à jour les recommandations T2T de 2014 concernant l’axSpA et le RPso (2). Elles préconisent que la cible thérapeutique doit viser une maladie inactive/rémission clinique ou, alternativement, une faible activité de la maladie (Low disease activity, LDA) (6). L’ASDAS-ID avec un score inférieur à 1,3 a été recommandé en 2017 comme outil pour définir la rémission (6). S’il n’est pas possible de l’atteindre, l’ASDAS-LDA avec un score compris entre 1,3 et 2,1 peut être une cible alternative acceptable (Fig. 1). Par ailleurs, les recommandations récentes de la Société française de rhumatologie (SFR) de 2021 confirment qu’un outil validé, soit un score composite, est indispensable pour évaluer l’activité de la maladie (7). Un seuil de 1,3 pour le score de l’ASDAS ou de 2/10 pour le BASDAI indiquant la rémission clinique peuvent être utilisés comme objectif à atteindre dans la prise en charge de l’axSpA (7).
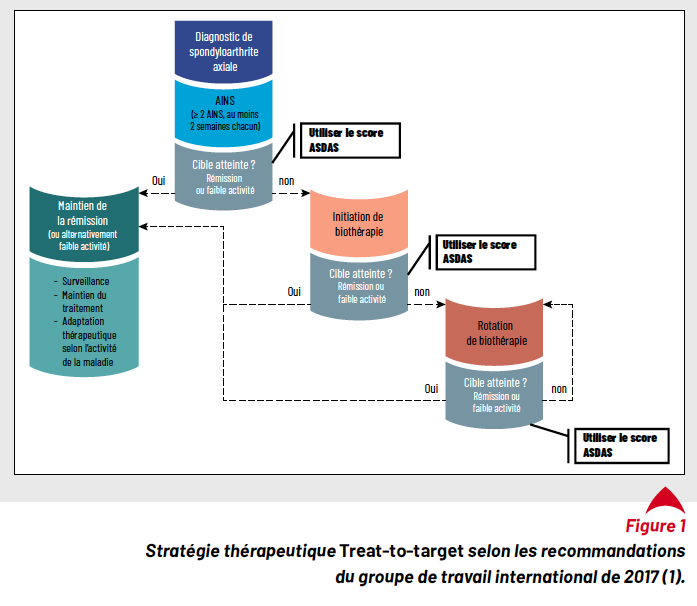
Les défis du choix de la cible
Bien que le concept T2T semble très prometteur dans l’axSpA, de nombreux défis persistent (Tab. 1).
Tout d’abord, concernant les scores d’activité de la maladie, l’utilisation de l’ASDAS seul pour définir la rémission est toujours controversée devant l’hétérogénéité de la maladie (4). La cible idéale pour mesurer l’activité de la maladie serait un score composite incluant les différentes manifestations cliniques, les mesures objectives de l’inflammation systémique, les PROs pour la qualité de vie et la fonction physique ainsi que les scores de progression structurale (8). Or il n’existe pas aujourd’hui de score composite qui intègre tous ces domaines. En pratique clinique, les rhumatologues prennent en compte d’autres aspects de la maladie pour définir un patient en rémission (4). L’utilisation d’anti-inflammatoires non stéroïdiens (AINS) et les manifestations extra-articulaires (telles que l’uvéite, le psoriasis et les maladies inflammatoires chroniques de l’intestin ou MICI), non incluses dans l’ASDAS, l’ASAS-PR et le BASDAI, sont des éléments importants à prendre en compte pour évaluer la réponse clinique sous traitement et peuvent conduire à un changement de traitement indépendamment des scores de l’ASDAS (4).
D’autre part, l’objectif de traitement doit être suffisamment simple pour être appliqué en pratique clinique tout en étant assez facile à atteindre. Néanmoins, des données récentes ont montré que le score ASDAS-ID maladie inactive était strict et qu’uniquement une petite proportion de patients est capable de l’atteindre (9). Les données de la cohorte DESIR ont montré que seulement 17 % des 614 patients ont atteint l’ASDAS-ID après 5 ans de suivi (9). Cela constitue un véritable obstacle à la stratégie T2T puisque l’ASDAS-ID a récemment été recommandé comme l’outil à utiliser. De plus, les outils recommandés pour le suivi, en particulier l’ASDAS, ne sont pas fréquemment utilisés par les rhumatologues en France justifiant l’intérêt de la mise en place des recommandations en pratique clinique (10).
Qu’est-ce que le suivi serré ou « Tight control » et quand envisager une intensification thérapeutique ?
Définition
Dans l’optique d’une stratégie T2T, un suivi serré est conseillé : il est généralement recommandé de surveiller l’activité de la maladie au moins tous les 6 mois (11) ou même plus étroitement (tous les 1 à 3 mois) chez les patients présentant une forte activité de la maladie (1). Une fois la rémission obtenue, cet état doit être maintenu dans le temps.
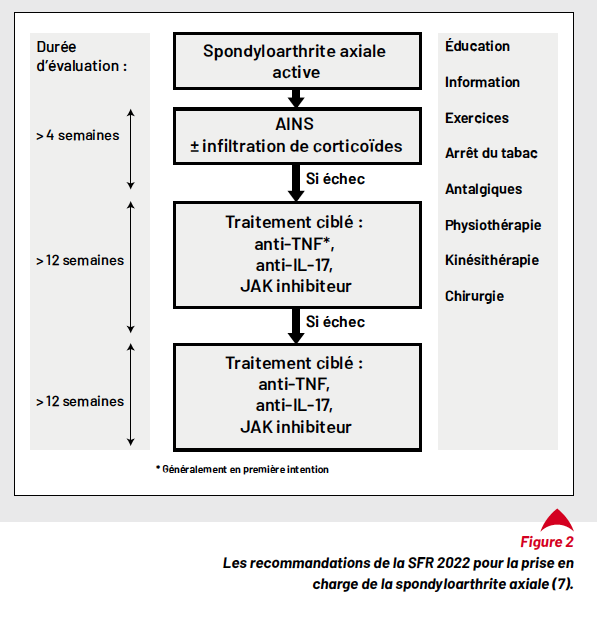
Dans une stratégie T2T, il est important d’atteindre la cible mais aussi de définir le temps adéquat pour atteindre la cible, ainsi que la durée minimale nécessaire de maintien de la rémission pour inhiber la progression structurale. La cible thérapeutique initialement fixée doit être atteinte après 6 mois du traitement (7). Cependant, il est admis qu’après 3 mois du traitement, une amélioration clinique pertinente doit être perçue pour justifier le maintien de la stratégie T2T choisie. Une réponse clinique étant une diminution du score de l’ASDAS ≥ 1,1 ou du BASDAI de 50 % (ou ≥ 2/10) (7). Dans le cas échéant, une intensification thérapeutique devrait être envisagée.
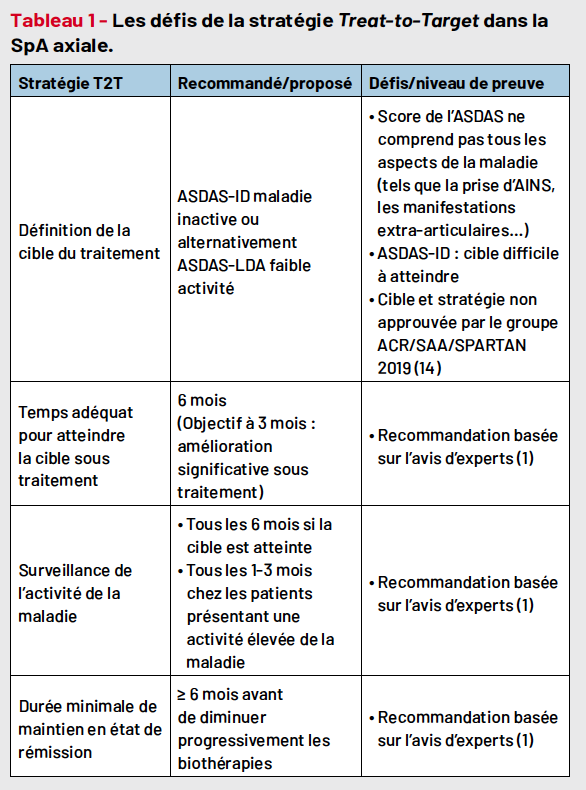
Selon les recommandations SFR 2022, en cas d’échec de deux anti-inflammatoires non stéroïdiens (AINS) pris à posologie maximale au moins 2 semaines chacun, l’intensification se fait par l’initiation d’un traitement ciblé (un anti-TNF, un anti-IL-17 ou un JAK inhibiteur) pour l’axSpA (Fig. 2). Un anti-TNF est généralement le traitement ciblé à utiliser en première intention et est à privilégier s’il existe une maladie inflammatoire chronique de l’intestin (MICI) ou une uvéite récidivante associées (7). Les anti-IL-17 sont à privilégier s’il existe un psoriasis cutané sévère associé. En cas d’échec primaire ou secondaire d’un premier traitement ciblé, la rotation vers un autre biomédicament devra être préconisée (7).
Les défis d’un suivi serré et de l’intensification thérapeutique
Tout d’abord, le suivi serré exige des visites fréquentes et l’utilisation de scores validés, ce qui est souvent compliqué pour les rhumatologues surchargés et pour les patients habitant dans des régions n’ayant pas d’accès à des rhumatologues à proximité (12).
Par ailleurs, on considère généralement que l’objectif du traitement doit être atteint dans les 6 mois, cependant, cela ne repose sur aucune preuve solide et est adapté par analogie aux autres rhumatismes inflammatoires chroniques (2). De plus, l’ASAS/EULAR (European Alliance for Associations for Rheumatology) a proposé le maintien de la rémission d’au moins 6 mois avant de diminuer progressivement les biothérapies mais cette recommandation est aussi fondée sur avis d’expert (13) (Tab. 2). Ainsi, il est important d’avoir plus de preuves et d’explorer davantage ces différents éléments qui font partie intégrante de la stratégie T2T.
L’intensification thérapeutique présente aussi plusieurs limites. Elle exige d’une part l’accès rapide aux biothérapies, l’adhérence des patients à la décision de l’escalade thérapeutique et d’autre part, une évaluation des effets secondaires ainsi qu’une preuve solide du rapport bénéfice/risque et coût/efficacité d’une telle stratégie. La stratégie T2T n’est pas universellement acceptée et n’a pas été approuvée récemment par le groupe de l’American College of Rheumatology/ Spondylitis Association of America/ Spondyloarthritis Research and Treatment Network (ACR/SAA/SPARTAN) en 2019 (14). Au contraire, ces derniers recommandent de ne pas utiliser l’approche T2T par rapport aux soins usuels en l’absence de preuves solides confirmant ses bénéfices et surtout en vue du risque de la rotation rapide des traitements disponibles pour atteindre l’objectif prédéfini (14).

Quelles sont les preuves à l’appui d’une approche T2T aujourd’hui ?
Jusqu’à ce jour il n’existe pas de démonstration formelle de la preuve de concept T2T.
Les arguments actuels en faveur d’une approche T2T par rapport aux soins usuels sont principalement fondés sur des preuves indirectes. Il est clair aujourd’hui que l’activité de la maladie est un déterminant majeur de la progression structurale dans l’axSpA (3, 15, 16). Dans l’étude longitudinale OASIS sur 12 ans, une augmentation d’une unité de l’ASDAS était liée à une augmentation de la progression radiographique de 0,7 sur le score radiographique modifié du rachis, mSASSS (modified Stoke Ankylosing Spondylitis Spinal Score) (17). Il est intéressant de noter qu’une inhibition radiographique plus importante a été observée chez les patients ayant atteint des scores d’ASDAS-ID par rapport aux patients présentant une activité de la maladie très élevée (ASDAS > 3,5) ou même ayant atteint une faible actvité-LDA (17). De plus, les biothérapies, à la fois les inhibiteurs du facteur de nécrose tumorale (anti-TNF) et les inhibiteurs de l’interleukine (anti-IL-17) approuvés dans l’axSpA, ont démontré leur potentiel à inhiber la progression structurale dans l’axSpA (3, 18, 19). Cette observation est en harmonie avec l’effet puissant des biothérapies sur l’inhibition des voies de l’inflammation dans l’axSpA (3). Par conséquent, l’abrogation précoce de l’inflammation et le contrôle strict de l’activité de la maladie peuvent inhiber la progression structurale.
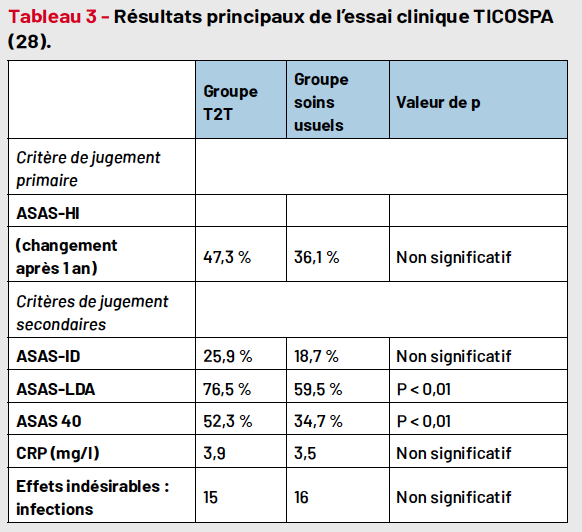
Néanmoins, les meilleures preuves proviennent d’essais cliniques comparant une approche T2T aux soins usuels. Dans l’axSpA, l’essai TICOSPA (Tab. 3), qui est le seul essai clinique publié à ce jour, n’a pas démontré la supériorité de la stratégie T2T (ASDAS cible < 2,1) par rapport aux soins usuels pour le critère de jugement primaire choisi : l’indice ASAS Health index (ASAS-HI) probablement dû à des limites méthodologiques (Tab. 4) (20). D’autres essais sur le T2T sont en cours dans l’axSpA (Tab. 2). Dans l’ensemble, malgré un essai clinique récent non conclusif, la stratégie T2T semble bénéfique dans la prise en charge de l’axSpA face aux multiples données disponibles actuellement.
Conclusion
La stratégie T2T, qui vise à atteindre l’ASDAS-ID/maladie inactive ou alternativement l’ASDAS-LDA/faible activité, constitue une approche prometteuse chez les patients atteints d’axSpA. Cependant, des difficultés persistent quant à la cible optimale à atteindre qui intégrerait tous les aspects de la maladie, le temps nécessaire pour atteindre la cible et la durée de maintien de la rémission afin d’améliorer le pronostic du patient. Le clinicien devra réfléchir à comment mettre en pratique la stratégie T2T en tenant compte des spécificités de chaque patient car ce domaine est un bon exemple de médecine personnalisée !
LG déclare les liens d’intérêt suivants : subventions de recherche d’Amgen, Galapagos, Lilly, Pfizer, Sandoz ; consultante pour AbbVie, Amgen, BMS, Galapagos, Gilead, GSK, Janssen, Lilly, Novartis, Pfizer, Samsung Bioepis, Sanofi-Aventis, UCB.
Bibliographie
1. Smolen JS, Schöls M, Braun J et al. Treating axial spondyloarthritis and peripheral spondyloarthritis, especially psoriatic arthritis, to target: 2017 update of recommendations by an international task force. Ann Rheum Dis 2018 ; 77 : 3-17.
2. Smolen JS, Braun J, Dougados M et al. Treating spondyloarthritis, including ankylosing spondylitis and psoriatic arthritis, to target: recommendations of an international task force. Ann Rheum Dis 2014 ; 73 : 6-16.
3. Aouad K, Ziade N, Baraliakos X. Structural progression in axial spondyloarthritis. Joint Bone Spine 2020 ; 87 : 131-6.
4. Aouad K, Wendling D, Breban M et al. Exploring remission concept in axial spondyloarthritis through the perception of rheumatologists using vignettes and priority ratings. Rheumatology 2021 ; keab711.
5. Sieper J, Rudwaleit M, Baraliakos X et al. The Assessment of SpondyloArthritis international Society (ASAS) handbook: a guide to assess spondyloarthritis. Annals of the Rheumatic Diseases 2009 ; 68 : ii1-44.
6. Zochling J. Measures of symptoms and disease status in ankylosing spondylitis: Ankylosing Spondylitis Disease Activity Score (ASDAS), Ankylosing Spondylitis Quality of Life Scale (ASQoL), Bath Ankylosing Spondylitis Disease Activity Index (BASDAI), Bath Ankylosing Spondylitis Functional Index (BASFI), Bath Ankylosing Spondylitis Global Score (BAS-G), Bath Ankylosing Spondylitis Metrology Index (BASMI), Dougados Functional Index (DFI), and Health Assessment Questionnaire for the Spondylarthropathies (HAQ-S). Arthritis Care Res 2011 ; 63 : S47-58.
7. Wendling D, Hecquet S, Fogel O et al. 2022 French Society for Rheumatology (SFR) recommendations on the everyday management of patients with spondyloarthritis, including psoriatic arthritis. Joint Bone Spine 2022 ; 105344.
8. Danve A, Deodhar A. Treat to Target in Axial Spondyloarthritis: What Are the Issues? Curr Rheumatol Rep 2017 ; 19 : 22.
9. Vegas LP, Sbidian E, Wendling D et al. Op0052 Factors Associated with Remission at 5 Years of Follow-up in Early Onset Axial Spondyloarthritis: Results from the Desir Cohort. Annals of the Rheumatic Diseases 2021 ; 80 : 27-8.
10. Che H, Etcheto A, Dernis E et al. Evaluation of collected outcome measures in axial spondyloarthritis in daily-care rheumatology settings: the experience of the RHEVER network. Clin Exp Rheumatol 2015 ; 33 : 851-7.
11. Kiltz U, Landewé RBM, van der Heijde D et al. Development of ASAS quality standards to improve the quality of health and care services for patients with axial spondyloarthritis. Ann Rheum Dis 2020 ; 79 : 193-201.
12. Solomon DH, Bitton A, Katz JN et al. Treat to Target in Rheumatoid Arthritis: Fact, Fiction or Hypothesis? Arthritis Rheumatol 2014 ; 66 : 775-82.
13. van der Heijde D, Ramiro S, Landewé R et al. 2016 update of the ASAS-EULAR management recommendations for axial spondyloarthritis. Ann Rheum Dis 2017 ; 76 : 978-91.
14. Ward MM, Deodhar A, Gensler LS et al. 2019 Update of the American College of Rheumatology/Spondylitis Association of America/Spondyloarthritis Research and Treatment Network Recommendations for the Treatment of Ankylosing Spondylitis and Nonradiographic Axial Spondyloarthritis. Arthritis Rheumatol 2019 ; 71 : 1599-613.
15. Ramiro S, van der Heijde D, van Tubergen A et al. Higher disease activity leads to more structural damage in the spine in ankylosing spondylitis: 12-year longitudinal data from the OASIS cohort. Ann Rheum Dis 2014 ; 73 : 1455-61.
16. Poddubnyy D, Protopopov M, Haibel H et al. High disease activity according to the Ankylosing Spondylitis Disease Activity Score is associated with accelerated radiographic spinal progression in patients with early axial spondyloarthritis: results from the GErman SPondyloarthritis Inception Cohort. Ann Rheum Dis 2016 ; 75 : 2114-8.
17. Ramiro S, Stolwijk C, van Tubergen A, van der Heijde D et al. Evolution of radiographic damage in ankylosing spondylitis: a 12 year prospective follow-up of the OASIS study. Ann Rheum Dis 2015 ; 74 : 52-9.
18. Baraliakos X, Østergaard M, Gensler LS et al. Comparison of the Effects of Secukinumab and Adalimumab Biosimilar on Radiographic Progression in Patients with Ankylosing Spondylitis: Design of a Randomized, Phase IIIb Study (SURPASS). Clin Drug Investig 2020 ; 40 : 269-78.
19. Molnar C, Scherer A, Baraliakos X et al. TNF blockers inhibit spinal radiographic progression in ankylosing spondylitis by reducing disease activity: results from the Swiss Clinical Quality Management cohort. Annals of the Rheumatic Diseases 2018 ; 77 : 63-9.
20. Molto A, López-Medina C, Van den Bosch FE et al. Efficacy of a tight-control and treat-to-target strategy in axial spondyloarthritis: results of the open-label, pragmatic, cluster-randomised TICOSPA trial. Ann Rheum Dis 2021 ; 80 : 1436-44.




