Contexte
L’étude de la physiopathologie de la polyarthrite rhumatoïde (PR) nous montre l’existence d’une pré-PR, caractérisée par un continuum entre l’exposition à des facteurs d’environnement (tabagisme, pollution atmosphérique, parodontite…) qui, sur un terrain génétiquement prédisposé (HLA-DR1, DR4…), déclenche un conflit immunologique se caractérisant (dans la PR séropositive) par la production d’anticorps anti-peptides citrullinés (ACPA). Ce conflit immunologique initial ne concerne pas le tissu synovial ; il apparaît au niveau de la muqueuse respiratoire (dans le cas d’une exposition au tabac par exemple) ou de la muqueuse buccale (parodontite). Progressivement, ce conflit immunologique s’enrichit, par la reconnaissance d’un nombre de plus en plus important d’épitopes citrullinés (chaîne alpha de la fibrine, vimentine…), s’associe à un syndrome inflammatoire biologique… avant que n’apparaissent les premiers signes cliniques : arthralgies inflammatoires, puis premières arthrites (Fig. 1) (1, 2). 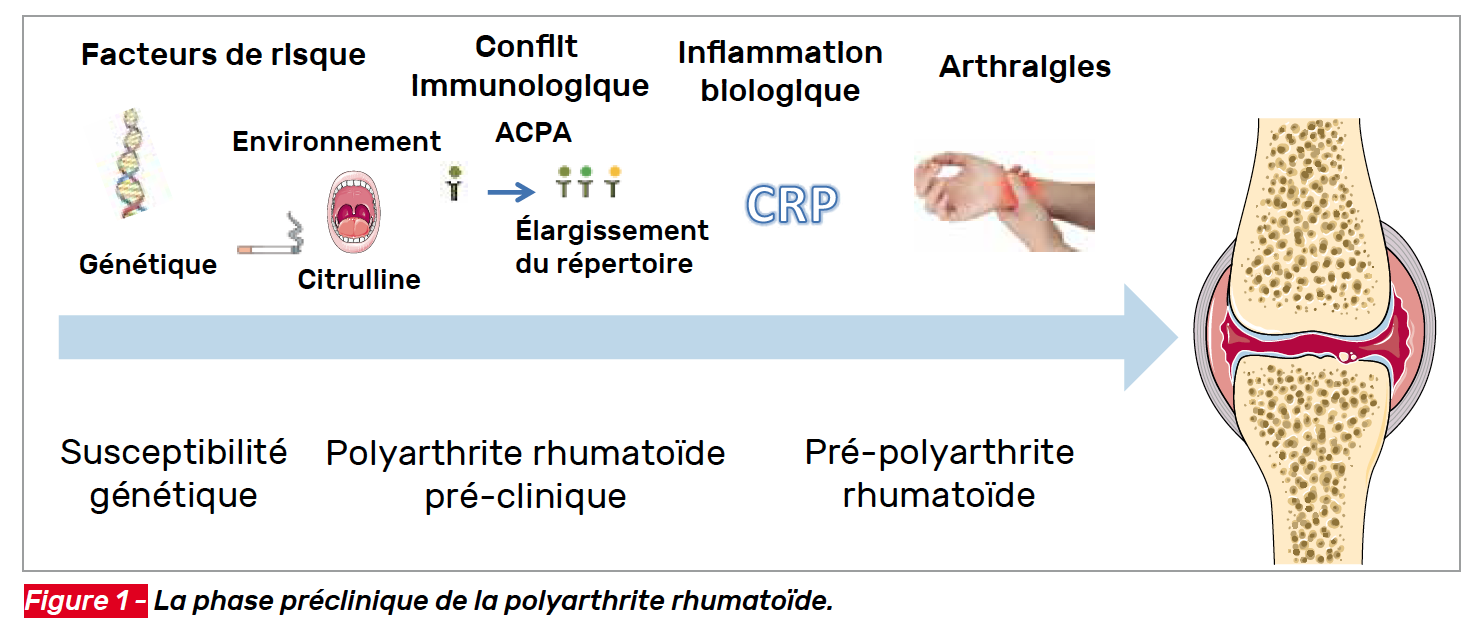
Parallèlement, plusieurs études ont montré l’existence d’une dysbiose intestinale, caractérisée par exemple dans le travail de José Scher par une surabondance de prévotelles (Prevotellae) dans les PR débutantes, faisant place ensuite à une surabondance de Bacteroidetes à la phase d’état de la maladie (3, 4). Par la suite, les caractéristiques de la dysbiose intestinale observée dans la PR rejoignent les observations faites dans de nombreuses maladies inflammatoires : une diminution globale de la diversité bactérienne, une diminution de la richesse en Firmicutes et une augmentation relative de l’abondance relative en Bacteriodetes par rapport à des témoins sains. Ce déséquilibre du microbiote intestinal est associé à l’activité de la maladie : les espèces bactériennes dont la richesse est diminuée chez les patients ayant une PR active voient leur abondance ré-augmenter sous méthotrexate par exemple, au prorata de l’efficacité du traitement (5, 6). Une étude montre que la présence de certaines bactéries intestinales permet de prédire la réponse au méthotrexate : six taxons sont surabondants chez les répondeurs au MTX (Negativicutes, Selenomonadeles, Prevotellaceae, Coprococcus, Bacteroides sp. 3-1-19, et Bilophila sp. 4-1-3) tandis que Eubacterium sp. 3-1-31 est surabondant chez les non-répondeurs (7), ce qui démontre l’influence majeure du microbiote intestinal sur l’activité de la maladie, mais également sur la réponse thérapeutique.
Ainsi, l’initiation du conflit immunologique caractéristique de la PR semble se faire sur une muqueuse, respiratoire ou buccale, tandis qu’une dysbiose du microbiote intestinal est associée à la phase active de la maladie, et est modulée par le traitement.
Il restait à comprendre le lien entre les phénomènes observés sur les muqueuses respiratoires et orales au stade de pré-PR, et l’installation de la dysbiose intestinale caractéristique de la PR active. Ce chaînon manquant pourrait être comblé par un travail récemment publié par une équipe du Colorado qui travaille de longue date sur la pré-PR et la PR récente.
L’auto-immunité de la PR naît bien d’un site muqueux
Dans un premier travail, Kinslow et al. ont recherché la présence de plasmablastes IgA et de plasmablastes IgG circulants, d’IgA et d’IgG chez des sujets ACPA + à risque de PR, des sujets atteints de PR récente et des témoins sains (8). Ils ont montré une prédominance de plasmablastes IgA et d’IgA circulants chez les sujets pré-PR, les plasmablastes IgG et les taux d’IgG circulants étant dominants chez les PR récentes. Le séquençage des IgA et des IgG et l’étude de leur réactivité vis-à-vis d’antigènes pertinents de la PR (filaggrine, fibrinogène, vimentine…) a montré une forte similitude entre le répertoire IgA des sujets à risque et le répertoire IgG des patients PR (Fig. 2). Ces observations tendent à confirmer que les auto-anticorps associés à la PR proviennent de réponses immunitaires muqueuses au stade préclinique de la maladie. Les similitudes entre les répertoires IgA des sujets à risque et IgG des patients PR suggèrent une évolution partagée entre immunité muqueuse et systémique au stade de PR active.
Cette équipe a ensuite émis l’hypothèse que ces plasmablastes IgA des sujets à risque pourraient avoir une réactivité croisée avec des bactéries du microbiote intestinal, favorisant l’émergence d’une auto-immunité et d’une inflammation systémique.
Démonstration d’une réactivité croisée des auto-anticorps d’origine muqueuse avec des bactéries du microbiote intestinal
Chriswell et al. ont entrepris d’identifier, au sein du microbiote intestinal, des cibles bactériennes spécifiquement reconnues par des auto-anticorps de patients atteints de PR, puis d’isoler ces bactéries pour tenter de comprendre leurs rôles potentiels dans des modèles murins (9).
À partir des clones de plasmablastes IgA et IgG de sujets à risque et de patients PR, ils ont constitué une bibliothèque de 94 anticorps reconnaissant des auto-antigènes pertinents pour la PR. Plus de 60 % de ces anticorps ciblaient également des bactéries intestinales, plus de la moitié se liant à des bactéries des taxons Lachnospiraceae et Ruminococcaceae.
Quel lien entre ces bactéries et la physiopathologie de la PR ?
Cette reconnaissance de bactéries intestinales est susceptible de moduler la composition du microbiote digestif et d’induire une réaction inflammatoire locale augmentant la perméabilité intestinale, la translocation d’antigènes bactériens, et favorisant l’apparition d’une immunité systémique (switch IgG).
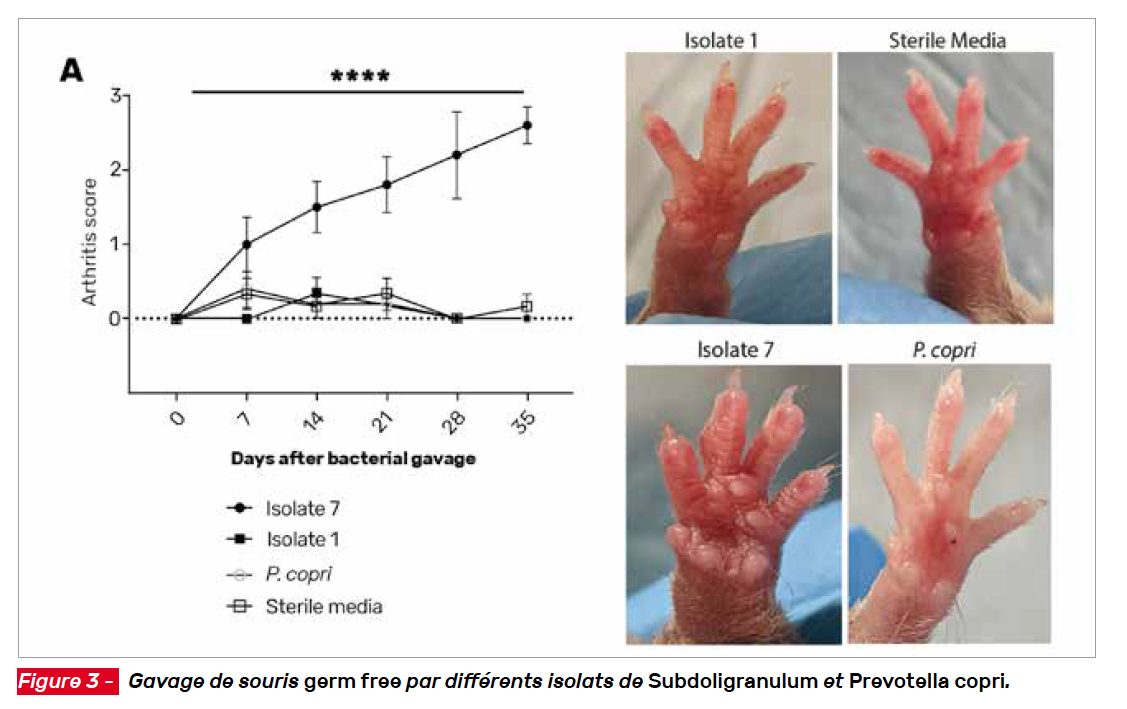
Les auteurs sont parvenus à isoler quelques souches d’une espèce du genre Ruminococcaceae subdoligranulum à partir des selles d’un sujet à risque dont le microbiote exprimait une forte abondance de ces taxons. Ils ont ensuite montré qu’une de ces souches (isolat 7) activait sélectivement les lymphocytes T CD4+ de patients atteints de PR, mais pas de témoins sains, confirmant que des patients PR ont des lymphocytes reconnaissant spécifiquement cette bactérie.
Les auteurs ont ensuite examiné l’effet des isolats de Subdoligranulum chez des souris gnotobiotiques (à microbiote réduit, contrôlé). Ils ont découvert que l’isolat 7 induisait la formation de follicules lymphoïdes intestinaux et la production d’auto-anticorps, et provoquait un gonflement des pattes de l’animal et une inflammation synoviale.
Le transfert de sérum de souris colonisées à des souris axéniques (germ free) a reproduit un phénotype de type PR, ainsi qu’un bref traitement antibiotique suivi d’un gavage de l’isolat 7 chez des souris exemptes d’agents pathogènes, mais qui abritent néanmoins un riche écosystème bactérien. Ces résultats suggèrent que l’isolat 7 de Subdoligranulum induit une réponse auto-immune qui cible ensuite le tissu synovial (Fig. 3).
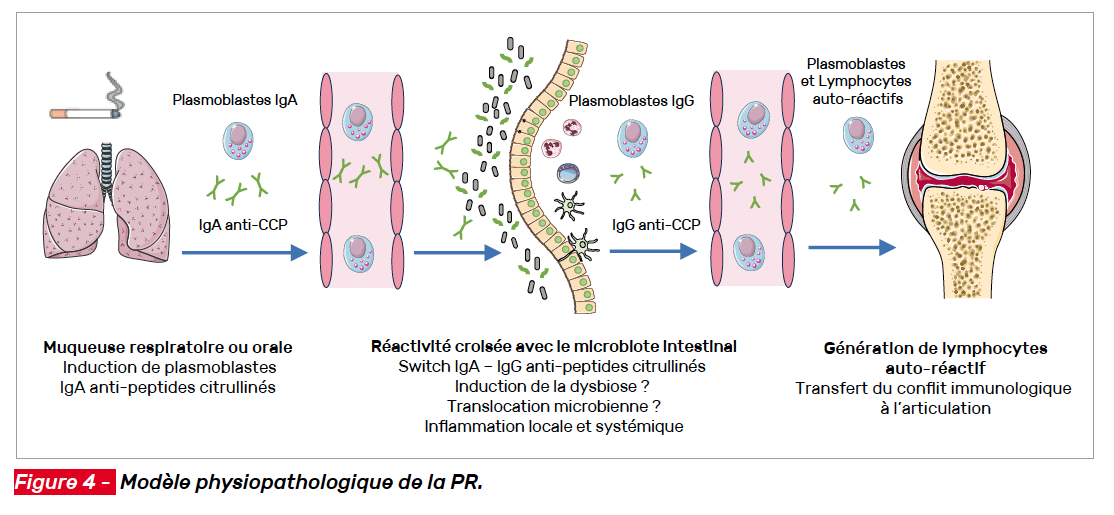
En résumé, ces travaux tendent à montrer que l’exposition à des facteurs environnementaux toxiques (tabac, polluants…) ou microbiens (parodontite) conduit, sur un terrain génétique propice, à un conflit immunologique naissant sur une muqueuse (respiratoire, orale…), conflit caractérisé par la production d’IgA reconnaissant des peptides citrullinés. La circulation des plasmablastes produisant ces IgA amène ces anticorps à interagir avec le microbiote digestif, les ACPA ayant une réactivité croisée avec de nombreuses bactéries du microbiote intestinal. Cette réactivité croisée est susceptible d’altérer le microbiote digestif (dysbiose), d’induire une inflammation et une augmentation de la perméabilité digestive qui elle-même favorise le développement d’une immunité systémique (production d’IgG et de lymphocytes T autoréactif). Ce conflit immunologique systémique serait responsable secondairement de l’atteinte articulaire (Fig. 4).
Ces résultats sont très spectaculaires. Ils devront bien évidemment être confirmés par d’autres travaux, reproduits par d’autres équipes. Mais ils offrent de réelles perspectives, par exemple l’élimination (par vaccination ?) des bactéries des espèces impliquées chez les sujets à risque de PR (10).
L’auteur déclare ne pas avoir de lien d’intérêt en relation avec cet article.
Mots-clés :
Pré-polyarthrite rhumatoïde, Polyarthrite rhumatoïde, Microbiote intestinal
Bibliographie
1. Schaeverbeke T, Truchetet ME, Richez C. When and where does rheumatoid arthritis begin? Joint Bone Spine 2012 ; 79 : 550-4.
2. Deane KD, Demoruelle MK, Kelmenson LB et al. Genetic and environmental risk factors for rheumatoid arthritis. Best Pract Res Clin Rheumatol 2017 ; 31 : 3-18.
3. Scher JU, Sczesnak A, Longman RS et al. Expansion of intestinal Prevotella copri correlates with enhanced susceptibility to arthritis. Elife 2013 ; 2 : e01202.
4. Scher JU, Ubeda C, Artacho A et al. Decreased bacterial diversity characterizes the altered gut microbiota in patients with psoriatic arthritis, resembling dysbiosis in inflammatory bowel disease. Arthritis Rheumatol 2015 ; 67 : 128-39.
5. Zhang X, Zhang D, Jia H et al. The oral and gut microbiomes are perturbed in rheumatoid arthritis and partly normalized after treatment. Nat Med 2015 ; 21 : 895-905.
6. Chen J, Wright K, Davis JM et al. An expansion of rare lineage intestinal microbes characterizes rheumatoid arthritis. Genome Med 2016 ; 8 : 43.
7. Gupta VK, Cunningham KY, Hur B et al. Gut microbial determinants of clinically important improvement in patients with rheumatoid arthritis. Genome Med 2021 ; 13 : 149.
8. Kinslow JD, Blum L, Deane KD et al. Elevated IgA Plasmablast Levels in Subjects at Risk of Developing Rheumatoid Arthritis. Arthritis Rheumatol 2016 ; 68 : 2372-83.
9. Chriswell ME, Lefferts AR, Clay MR et al. Clonal IgA and IgG autoantibodies from individuals at risk for rheumatoid arthritis identify an arthritogenic strain of Subdoligranulum. Sci Transl Med 2022 ; 14 : eabn5166.
10. Upadhyay R, Littman DR. Provocateurs of autoimmunity within the gut microbiota. Sci Transl Med 2022 ; 14 : eadd3901.





