Introduction
Vous n’avez pas pu échapper aux conclusions du comité de pharmacovigilance (PRAC) de l’Agence européenne des médicaments (EMA) concernant les inhibiteurs de JAK ! Ces conclusions ont été relayées par l’industrie et de nombreux médias depuis fin octobre 2022, et elles ont été amplement commentées durant le dernier Congrès français de rhumatologie. Après l’annonce du PRAC de la mise en œuvre d’une procédure d’évaluation des JAKi au vu des résultats de l’étude Oral Surveillance, on pouvait s’attendre à des restrictions d’utilisation beaucoup plus sévères des inhibiteurs de JAK. Nombre d’entre nous, à la lecture du document de recommandations de minimisation des risques, ont pensé que l’on avait fait beaucoup de bruit pour pas grand-chose…
Cette lecture traduit en fait une méconnaissance du rôle et des procédures du Pharmacovigilance Risk Assessment Committee (PRAC). Il est intéressant de comprendre le fonctionnement de cet organisme, et plus généralement de connaître l’historique et le fonctionnement de la pharmacovigilance en France et dans le monde pour appréhender ce qui s’est déroulé pour les JAKi, pour mieux comprendre et interpréter les conclusions du PRAC concernant ces produits.
Le parcours et la vie du médicament
L’histoire d’un médicament est longue et complexe, elle débute longtemps avant sa commercialisation et le chemin est semé d’embûches (Fig. 1) (1) !
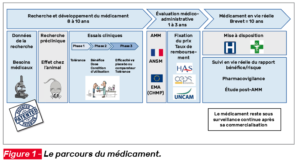
La lecture de cet article est réservée aux abonnés.
Pour accéder à l'article complet
Découvrez nos offres d'abonnement
Abonnez-vous à la revue et accédez à tous les contenus du site !
- Tous les contenus de la revue en illimité
- Les numéros papier sur l'année
- Les newsletters mensuelles
- Les archives numériques en ligne
ou
Achetez cet article
ou
Inscrivez-vous gratuitement sur Rhumatos.fr et bénéficiez de l'accès à de nombreuses catégories du site !
- Accès aux catégories d'articles exclusives
- Les newsletters mensuelles
- Votre historique de commandes en ligne




