Le millésime 2023 du meeting de l’ACR fut assez riche en présentation en matière de pathologies osseuses, mais surtout des ostéoporoses, compte tenu du fait que l’ostéoporose est une des plus fréquentes comorbidités associées aux rhumatismes inflammatoires chroniques, mais aussi aux connectivites qui sont les vedettes du congrès.
TOP 1 – Dénosumab : miscellanées
En l’absence d’étude clinique randomisée face-face opposant le dénosumab (DMAB) et l’acide zolédronique (ZOL) pour étudier la diminution du risque fracturaire, un travail a pris en considération l’efficacité anti-fracturaire de ces deux traitements dans une étude rétrospective chez des femmes de plus de 66 ans bénéficiaires de Medicare qui initiaient le DMAB (N = 89 990) ou le ZOL (N = 36 861) entre janvier 2012 et décembre 2018 et n’ayant pas d’antécédent de traitement anti-ostéoporotique.
L’analyse statistique rigoureuse pour ce type d’étude en vraie vie rétrospective (analyses par modèle de régression logistique multivariées et modèle de Cox multivariés) permettait d’estimer les risques relatifs associés au traitement par DMAB comparé au ZOL pour différents risques de fracture. Les résultats du tableau 1a témoignent des réductions de risque cliniquement pertinentes obtenues avec le DMAB comparativement au ZOL. À partir de la même base de données et sur une même période de temps, une comparaison était faite entre des femmes initialement traitées par DMAB (N = 89 115) ou par alendronate (ALN) (N = 389 536) sur la réduction du risque fracturaire. Le tableau 1b illustre clairement également dans une cohorte de près d’un million de patientes l’efficacité supérieure du DMAB versus l’ALN.
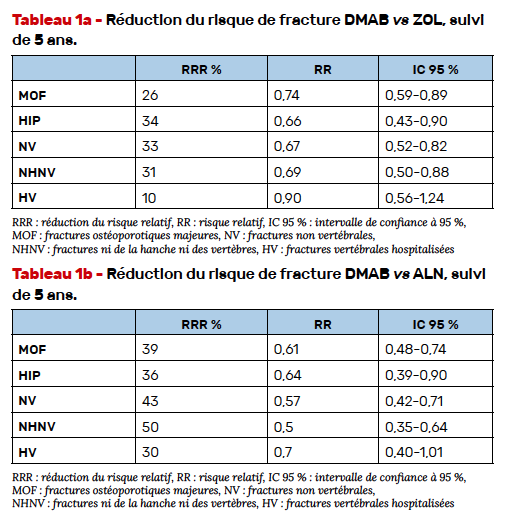
Les biosimilaires du DMAB seront sans doute disponibles en France dans un avenir proche. Une étude randomisée en double aveugle comparant l’efficacité du DMAB (PROLIA) et d’un biosimilaire SB16 chez 457 femmes ménopausées a fait l’objet d’une présentation en poster montrant la biosimilarité du SB 16 avec le DMAB PROLIA du fait de son efficacité équivalente par rapport aux marges prédéfinies en termes de DMO au rachis (Fig. 1) et de données comparables de sécurité d’emploi, de PK, d’effet sur les marqueurs du remodelage et d’immunogénicité.
• Curtis JR et al. Comparative Effectiveness of Denosumab versus Alendronate Among Postmenopausal Women with Osteoporosis in the U.S. Medicare Program. ACR 2023 ; abstr. 2008.
• Curtis JR et al. Comparative Effectiveness of Denosumab versus Zoledronic Acid Among Postmenopausal Women with Osteoporosis in the U.S. Medicare Program. ACR 2023 ; abstr. 2529.
• Eastell R et al. A Randomized, Double-blind, Phase III Study to Compare SB16 (Proposed Denosumab Biosimilar) to Reference Denosumab in Patients with Postmenopausal Osteoporosis. ACR 2023 ; abstr. 1997.
TOP 2 – Romosozumab versus dénosumab chez des patients à haut risque d’ostéoporose cortico-induite : une étude pilote randomisée
Bien qu’incomplètement élucidée, la physiopathologie de l’ostéoporose cortico-induite (OPCI) diffère de l’ostéoporose post-ménopausique, en particulier par la présence d’une inhibition profonde et prolongée de la formation osseuse plus que d’une augmentation de la résorption osseuse présente au début de la maladie inflammatoire sous-jacente ayant requis le recours aux glucocorticoïdes. La logique chez des patients à haut risque, dans l’OPCI, d’utiliser en première ligne thérapeutique les agents anaboliques a déjà été discutée [1]. Le romosozumab (ROMO) est un anticorps monoclonal humanisé ciblant la sclérostine qui inhibe l’activation de la voie Wnt pour la formation osseuse et favorise la résorption osseuse en stimulant la production de RANKL par les ostéoclastes. En inhibant la sclérostine, le ROMO a une double action en diminuant la résorption mais surtout en favorisant la formation osseuse. C’est particulièrement dans l’ostéoporose post-ménopausique que le développement du ROMO s’est poursuivi même si des données précliniques dans l’OPCI existent [2].
Seule une étude rétrospective a mis en évidence des gains plus élevés de DMO au rachis après 12 mois de traitement par ROMO, comparés à ceux observés, après à la même durée de traitement par DMAB (12,5 vs 7,2 %).
Les auteurs ont dessiné un essai randomisé contrôlé en ouvert de 24 mois comparant le ROMO et le DMAB chez des patients à haut risque d’OPCI. Les critères d’inclusion étaient les suivants : âge supérieur ≥ 18 ans, recevant une dose ≥ 5 mg par jour de prednisone pour au moins 12 mois et à risque modéré ou élevé de fracture défini par un T Score ≤ -2,5 pour les patients de plus de 40 ans ou d’un T-Score ≤ -3 pour ceux de moins de 40 ans, ou ayant un score FRAX de fractures majeures ostéoporotiques élevé à 10 ans.
Les critères d’exclusion principaux étaient les suivants : usage antérieur de DMAB, de ROMO, de tériparatide, de biphosphonates intraveineux, de strontium dans les derniers 24 mois ; femmes préménopausées ayant envisagé une grossesse, antécédents de pathologies cardiovasculaires (athérosclérose) ou maladie cérébrovasculaire et enfin les autres maladies osseuses non ostéoporotiques (ostéomalacie, ostéodystrophie rénale, hyperparathyroïdie, hypocalcémie inexpliquée) et créatinine sérique ≥ 200 µmol/l.
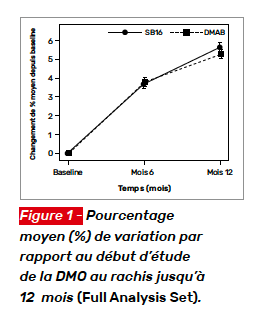
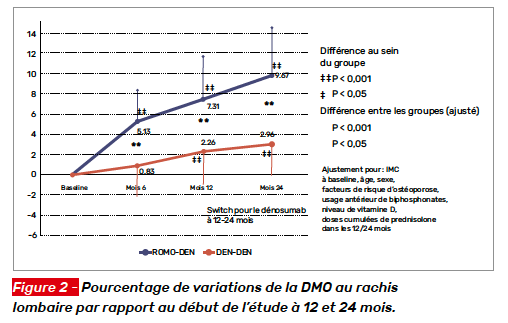
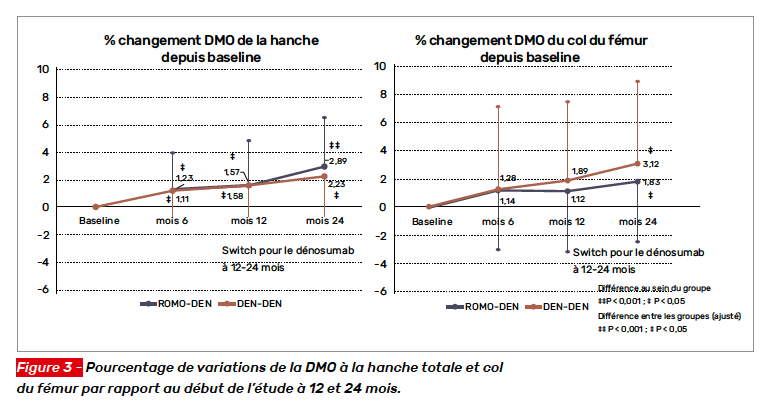
Le critère principal de jugement était le pourcentage de variation de la DMO à 12 mois au rachis lombaire. Parmi les critères secondaires de jugement figuraient l’incidence de nouvelle fracture vertébrale et d’autres fractures majeures. Au total, 70 patients ont été inclus, la moitié recevant du DMAB, l’autre du ROMO. Il s’agissait de femmes (96 %) âgées de 62,6 ± 9,1 ans. La pathologie sous-jacente était dans la moitié des cas un lupus, la dose moyenne de prednisolone à l’entrée dans l’étude était de 6,6 ± 3,5 mg/j ; la durée de traitement étant de 10,7 ± 7,4 ans. Parmi eux, 47 % avaient reçu un biphosphonate per os avant la première dose du traitement à l’étude. Les patientes recevaient toutes du calcium 3 g et de la vitamine D 1 000 UI par jour. Après un an, toutes les patientes recevaient du DMAB. Les variations de DMO au rachis lombaire par rapport au début d’étude sont illustrées figure 2. Les variations à la hanche sont présentées figure 3. À 12 mois, trois patientes du groupe ROMO avaient une aggravation ou une nouvelle fracture vertébrale (p = 0,24, test exact de Fisher) ; à 24 mois, quatre patientes du groupe ROMO et une du groupe DMAB avaient une aggravation ou une nouvelle fracture vertébrale (p = 0,36 test exact de Fisher). Aucune fracture non vertébrale n’est survenue pendant le suivi de 2 ans. Dans cette étude pilote chez des patientes recevant de longue date un traitement par des glucocorticoïdes, le ROMO s’est montré supérieur au DMAB sur la DMO au rachis, mais pas sur les sites fémoraux.
En termes d’événements fracturaires le peu ne permet pas de conclure. Il faut attendre la parution de l’article original et sans doute d’autres études pour conclure définitivement à l’efficacité du ROMO et à sa bonne tolérance dans le cadre de l’OPCI en sachant que dans l’étude présente les deux traitements étaient bien tolérés avec un peu plus de réactions au site d’injection sous-cutanée dans le groupe ROMO (mais plus d’injections par an).
1. Lespessailles E, Chapurlat R. High fracture risk patients with glucocorticoid-induced osteoporosis should get an anabolic treatment first. Osteoporosis International 2020 ; 31 : 1829–34.
2. Achiou Z, Toumi H, Touvier J et al. Sclerostin antibody and interval treadmill training effects in a rodent model of glucocorticoid-induced osteopenia Bone 2015 ; 81 : 691–701.
3. Kobayakawa T, Miyazaki A, Saito M et al. Denosumab versus romosozumab for postmenopausal osteoporosis treatment. Scientific Reports 2021 ; 11 : 11801.
4. Ma WH et al. Romosozumab versus Denosumab in High-risk Patients Treated with Glucocorticoids Interim 12-month Results from a Pilot Randomized Controlled Trial. ACR 2023 ; abstr. 2429.
TOP 3 – Docteur, mon calcium ne se dépose pas au bon endroit ! (Fractures et chondrocalcinose)
Une association positive entre chondrocalcinose articulaire (CCA) et ostéopénie a été mise en évidence dans deux grandes études transversales. Cependant, le risque de fracture n’a pas été évalué.
Dans cette étude de cohorte appariée analysant les données électroniques de santé d’un grand centre hospitalier académique (Boston), les auteurs ont comparé dans la période 1991-2017 les patients ayant eu une crise de CCA et ceux n’en ayant pas eu. Le critère principal de jugement était la survenue de la première fracture de fragilité (humérus, poignet, hanche ou bassin). Les fractures de fragilité étaient identifiées par des algorithmes publiés en utilisant des codes procéduraux et diagnostiques ayant une valeur prédictive positive > 90 %. Les patients ayant des antécédents fracturaires en début d’étude étaient exclus. De nombreux covariants ont été étudiés (Tab. 2), les taux d’incidence (IR) et leur ratio (IRR) ont été estimés pour toute fracture confondue et par site fracturaire. Des modèles de Cox estimaient les hazards ratios ajustés (HR) pour les fractures. Des analyses de sensibilité excluant les patients avec PR, avec glucocorticoïdes ou avec traitement de l’ostéoporose ont été effectuées.
Les auteurs ont identifié 1 148 patients ayant eu une crise articulaire aiguë de CCA (crise de pseudogoutte ou liquide synovial montrant la présence de cristaux de pyrophosphate de calcium) qu’ils ont appariés à 3 730 comparateurs (Tab. 2). Les taux d’incidence fracturaires étaient deux fois plus élevés chez les patients ayant un antécédent de crise de CCA : 11,2 contre 5,6 pour 1 000 personnes-années (Tab. 3). Les courbes d’incidence cumulée divergeaient rapidement avec un risque de fracture HR de 1,8 (IC 95 % 1,4–2,4) (Fig. 4).
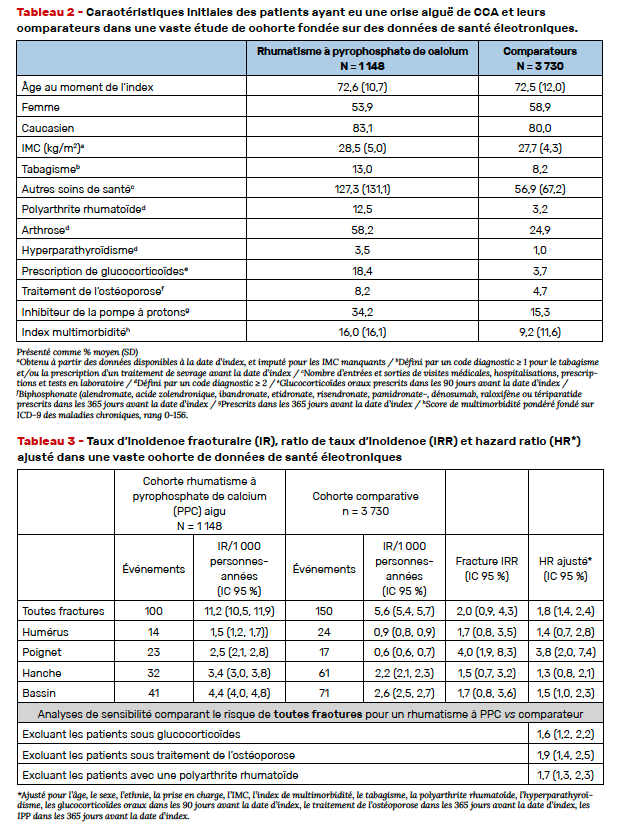
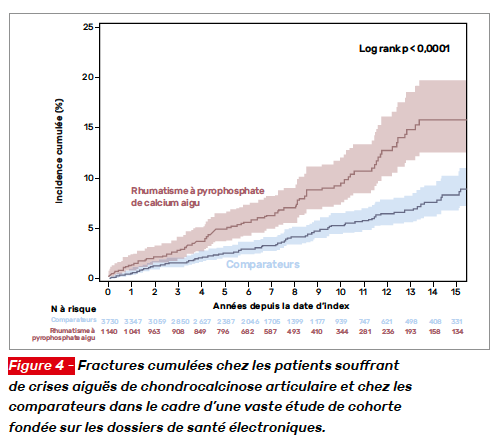
Les résultats étaient les mêmes dans les analyses de sensibilité. Il s’agit de résultats menés dans une assez vaste cohorte, il manque cependant à cette étude des résultats densitométriques et une évaluation des chutes. Une hypothèse mécanistique pourrait être celle d’une perte de fonction de l’ostéoprotégérine liée aux troubles du remodelage osseux sous chondral due à la CCA. À suivre donc pour confirmation.
Sara Tedeschi et al. Fractures in Patients with Acute CPP Crystal Arthritis versus Matched Comparators in a Large Cohort Study. ACR 2023 ; abstr. 0235.
TOP 4 – Facteurs de risque de perte osseuse dans le lupus systémique érythémateux (SLE)
D’après l’index des complications associées au lupus (Systemic Lupus Erythematosus International Collaborating Clinics/American College of Rheumatology), la pathologie musculosquelettique et, au premier chef, les fractures ostéoporotiques figurent au premier plan. Cependant la littérature fait état de résultats discordants concernant les facteurs de risque de l’ostéoporose dans le SLE.
S’appuyant sur les données d’une cohorte longitudinale, cohorte Hopkins (États-Unis), incluant 1 476 patients et analysant les résultats de la densitométrie osseuse (4 283 examens), les auteurs ont estimé la relation entre des caractéristiques patients variées (Tab. 4) et l’ostéoporose densitométrique au rachis lombaire en utilisant des équations d’estimation généralisées (régression logistique avec GEE). Un T-score ≤ -2,5 au rachis lombaire était observé dans 9,8 % des mesures. Dans l’analyse univariée, l’âge, un faible IMC, un SLEDAI élevé, la dose moyenne de prednisone et un antécédent de C3 ou C4 bas sont associés à une DMO ostéoporotique au rachis (Tab. 4).
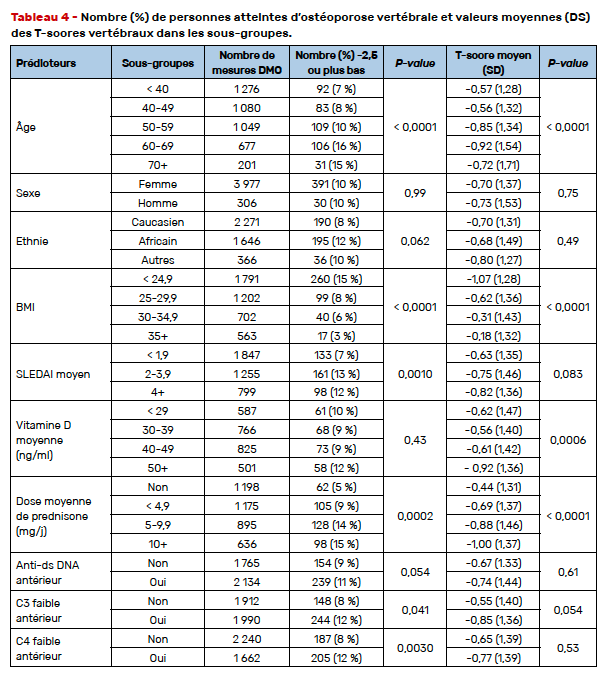
Dans l’analyse multivariée contrôlant les effets de l’âge, de l’ethnie, de la dose moyenne de prednisone étaient mis en évidence des risques plus élevés de DMO ≤ -2,5 au rachis quand l’âge était de plus de 40 ans, en cas d’ethnie afro-américaine, en cas de SLEDAI > 2 et en cas d’antécédent de prise de glucocorticoïdes, qu’elle qu’en soit la dose. Un IMC > 25 était protecteur (Tab. 5). Ni le premier dosage de 25 OH vitamine D, ni le dosage effectué dans les 30 jours précédant l’examen ostéodensitométrique n’étaient associés au statut d’ostéoporose au rachis lombaire (Tab. 6). En revanche, un taux moyen de 25 OH vitamine D > 50 mg/ml était associé à une DMO rachis basse.
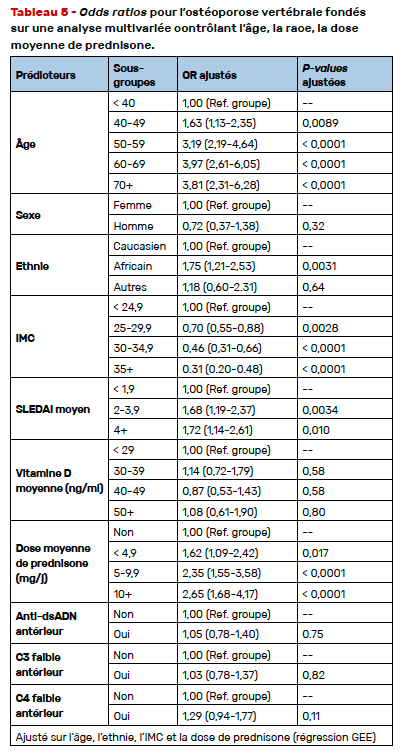
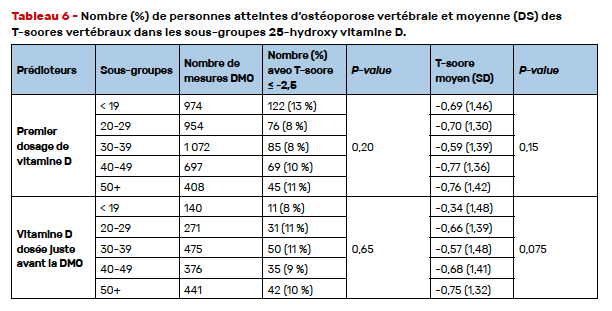
Surpris par le fait que la population d’ethnie afro-américaine soit plus à risque d’ostéoporose densitométrique au rachis, j’ai demandé aux auteurs si leurs données avaient été ajustées sur l’activité et la sévérité de la maladie, les auteurs m’ont affirmé que c’était le cas. On peut aussi critiquer l’utilisation exclusive du T-score dans l’étude comportant des hommes et des femmes non ménopausées.
Madanchi N et al. Risk Factors for Bone Loss in Systemic Lupus Erythematosus. ACR 2023 ; abstr. 2527.
TOP 5 – Insuffisance de prise en charge de l’ostéoporose : une tendance qui s’aggrave
Dans une cohorte rétrospective de femmes âgées de 50 ans et plus, sur la période 2012-2021, l’incidence du risque de nouvelle fracture chez des femmes ménopausées ayant un antécédent personnel de fracture a été étudié.
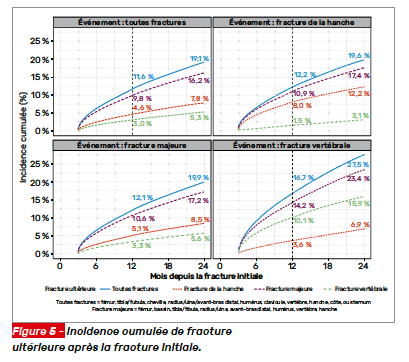
Cette cohorte concerne des femmes appartenant à la base de données avantage Medicare. Parmi les 483 564 femmes (moyenne d’âge 74,8 ans) ayant eu une fracture initiale, quel qu’en soit le site, l’incidence cumulée à 1 an d’une nouvelle fracture, quel qu’en soit le siège, est de 11,6 % augmentant à 19,1 % à 2 ans (Fig. 5). Après une fracture vertébrale initiale, le risque à 1 an de se refracturer une vertèbre est de 16,7 % passant à 2 ans à 27,5 %. La plupart des patientes ne recevaient cependant pas de traitement pharmacologique à 1 an (91,7 %), ni d’ailleurs à 2 ans (89,4 %) après leur fracture initiale.
En dépit de l’existence de recommandations cliniques spécifiant que l’ostéoporose fracturaire est une maladie chronique nécessitant une prise en charge pharmacologique, ces donnés récentes portant sur une période de 10 ans montrent que les taux de fractures récurrentes à 2 ans sont élevés alors même que les traitements pharmacologiques de l’ostéoporose sont sous-utilisés dans cette population pourtant à risque élevé de nouvelles fractures.
Kim M et al. Current Trends in the Risk of Subsequent Fracture After Initial Fracture, and Post-Fracture Treatment Among Commercially Insured Postmenopausal Women in the United States. ACR 2023 ; abstr. 2528.
L’auteur déclare avoir des liens d’intérêt pour des interventions ponctuelles en tant qu’expert ou orateur avec Abbvie, Amgen, Expanscience, Galapagos, Lilly, MSD, Novartis, Pfizer, Theramex, UCB.




